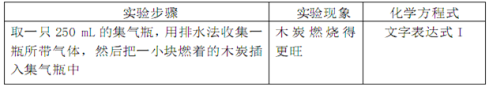
题目内容
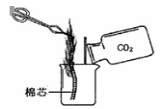
【题目】探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
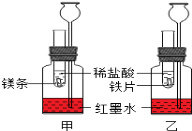
①该实验的目的是_______________、_______________。
两支长颈漏斗中产生的现象的不同之处是_______________。
②若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量_______________(填“多”、“少”或“一样多”)。
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品,加入足量的稀盐酸,搅拌、过滤、洗涤、干燥、称量所得固体质量。
B:称取一定质量的样品,加入一定量的硫酸铜溶液,搅拌、 过滤、洗涤、干燥、称量所得固体质量。
③两种方案,你认为不能达到目的是________(填“A”或“B”),理由是_____________。
④在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数_______________(填“偏大”、“偏小”、“不变”或“无法判断”)。
【答案】①比较镁、铁与稀盐酸反应的剧烈程度 比较相同时间内镁、铁与稀盐酸反应放出热量的多少 ; 甲装置长颈漏斗中的液面上升比乙装置中高 ②一样多 ③B ;一定量的硫酸铜溶液可能不能完全除去杂质铁(或生成的铜覆盖在铁屑表面,导致铁不能全部反应) ④偏小
【解析】
试题分析:探究活动一:因为是一组对比试验,故① 该实验的目的是比较镁、铁与稀盐酸反应的剧烈程度、比较相同时间内镁、铁与稀盐酸反应放出热量的多少,两支长颈漏斗中产生的现象的不同之处是甲装置长颈漏斗中的液面上升比乙装置中高;② 若实验所用的金属均过量,则甲装置中产生的H2 比乙装置中产生的H2质量一样多 ,因为金属剩余计算生成的氢气的质量按酸的计算,探究活动二:③ 两种方案,你认为不能达到目的是B,因为一定量的硫酸铜溶液可能不能完全除去杂质铁(或生成的铜覆盖在铁屑表面,导致铁不能全部反应),④ 在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数偏小,因为在加热的过程中铜会部分转化为氧化铜质量变大,故铁的质量分数变小