题目内容
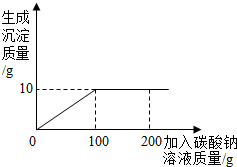 (2012?犍为县二模)某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示.
(2012?犍为县二模)某盐场生产的食盐产品中含有氯化钙杂质.某化学兴趣小组为测定该食盐产品中氯化钠的含量,进行了如下实验:取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中逐滴加入碳酸钠溶液,反应关系如图所示.(1)当氯化钙与碳酸钠恰好完全反应时,消耗的碳酸钠溶液的质量是
100
100
g.(2)样品中氯化钠的质量是多少?
(3)当碳酸钠与氯化钙恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
分析:(1)由生成沉淀的质量曲线,加入100g碳酸钠溶液时,氯化钙与碳酸钠恰好完全反应;
(2)由恰好完全反应时生成沉淀的质量,根据反应的化学方程式,计算样品中氯化钙的质量,样品质量与氯化钙质量差即样品中氯化钠的质量;
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液为氯化钠溶液,其中溶质氯化钠质量为样品中氯化钠与反应生成氯化钠的质量和,利用质量守恒定律,求得反应后溶液的质量,利用溶液中溶质的质量分数计算公式计算所得溶液中溶质的质量分数.
(2)由恰好完全反应时生成沉淀的质量,根据反应的化学方程式,计算样品中氯化钙的质量,样品质量与氯化钙质量差即样品中氯化钠的质量;
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液为氯化钠溶液,其中溶质氯化钠质量为样品中氯化钠与反应生成氯化钠的质量和,利用质量守恒定律,求得反应后溶液的质量,利用溶液中溶质的质量分数计算公式计算所得溶液中溶质的质量分数.
解答:解:(1)由生成沉淀的质量曲线,当氯化钙与碳酸钠恰好完全反应时,消耗碳酸钠溶液的质量为100g;
(2)设样品中氯化钙的质量为x,生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
=
=
解得:x=11.1g,y=11.7g;
所以样品中氯化钠的质量=13.4g-11.1g=2.3g
(3)所得溶液中溶质质量分数为:
×100%=7%
故答案为:(1)100;(2)样品中氯化钠的质量是2.3g;(3)所得溶液中溶质的质量分数是7%.
(2)设样品中氯化钙的质量为x,生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
| 111 |
| x |
| 100 |
| 10g |
| 117 |
| y |
解得:x=11.1g,y=11.7g;
所以样品中氯化钠的质量=13.4g-11.1g=2.3g
(3)所得溶液中溶质质量分数为:
| 2.3g+11.7g |
| 13.4g+96.6g+100g-10g |
故答案为:(1)100;(2)样品中氯化钠的质量是2.3g;(3)所得溶液中溶质的质量分数是7%.
点评:主要考查学生对完全反应的认识,以及运用化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目