题目内容
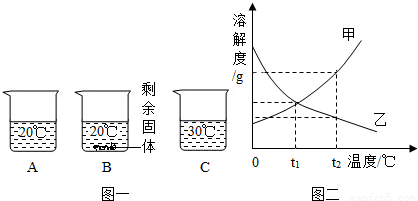
(2011?南昌)向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示.
(1)烧杯中的溶液一定属于饱和溶液的是
(2)图二能表示NaNO3溶解度曲线的是
(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.

(1)烧杯中的溶液一定属于饱和溶液的是
B
B
(填序号);(2)图二能表示NaNO3溶解度曲线的是
甲
甲
(填“甲”或“乙”);(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的
BD
BD
(填序号).A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
分析:根据溶液中是否有未溶解的溶质存在来判断溶液是否饱和,根据硝酸钠的溶解度随温度的变化确定硝酸钠的溶解度曲线;根据两种物质的溶解度曲线首先确定出在t2℃时两种物质的溶解度,从而可以确定出在t2℃时两种物质的饱和溶液中溶质的质量分数,及比较溶液中溶剂的多少;然后根据两种物质的溶解度随温度变化的情况,分析出降温至t1℃时两种物质的溶解度的大小,溶液状态的变化及溶液中各个量的变化.
解答:解:(1)由于在三个烧杯中只有B有未溶解的固体存在,因此B中的溶液一定是饱和溶液,故答案为:B
(2)由于在等量的30℃的水中全部溶解了25g硝酸钠,而20℃的水没有全部溶解25g硝酸钠,说明硝酸钠的溶解度随温度的升高而增大,故答案为:甲
(3)A、由于甲的溶解度随温度的降低而减小,因此它的饱和溶液降温后会有晶体析出,但溶液仍为饱和溶液;但乙的溶解度随温度的降低而增大,因此它的饱和溶液降温后就会变成不饱和溶液,故A错误;
B、由于在降温过程中溶剂的质量并没有发生变化,因此只要比较出它们原来的溶剂的多少即可;根据两种物质的溶解度曲线可知,在t2℃时,甲的溶解度大于乙的溶解度,即饱和溶液中溶质的质量分数甲>乙,即等量的饱和溶液中溶质的质量甲>乙,则溶剂甲<乙,故B正确;
C、由于甲溶液随着温度的降低会有晶体析出,因此溶液质量会减小,而乙的溶液中没有晶体析出溶液质量不会发生变化,因此降温后溶液的质量甲<乙,故C错误;
D、在t1℃时,两物质的溶解度相等,即两物质的饱和溶液中溶质的质量分数相等,但乙溶液已经不再是饱和溶液,因此溶液中溶质的质量分数甲>乙,故D正确;
故选BD
(2)由于在等量的30℃的水中全部溶解了25g硝酸钠,而20℃的水没有全部溶解25g硝酸钠,说明硝酸钠的溶解度随温度的升高而增大,故答案为:甲
(3)A、由于甲的溶解度随温度的降低而减小,因此它的饱和溶液降温后会有晶体析出,但溶液仍为饱和溶液;但乙的溶解度随温度的降低而增大,因此它的饱和溶液降温后就会变成不饱和溶液,故A错误;
B、由于在降温过程中溶剂的质量并没有发生变化,因此只要比较出它们原来的溶剂的多少即可;根据两种物质的溶解度曲线可知,在t2℃时,甲的溶解度大于乙的溶解度,即饱和溶液中溶质的质量分数甲>乙,即等量的饱和溶液中溶质的质量甲>乙,则溶剂甲<乙,故B正确;
C、由于甲溶液随着温度的降低会有晶体析出,因此溶液质量会减小,而乙的溶液中没有晶体析出溶液质量不会发生变化,因此降温后溶液的质量甲<乙,故C错误;
D、在t1℃时,两物质的溶解度相等,即两物质的饱和溶液中溶质的质量分数相等,但乙溶液已经不再是饱和溶液,因此溶液中溶质的质量分数甲>乙,故D正确;
故选BD
点评:本题难度较大,主要考查了固体溶解度曲线所表示的意义,及根据固体的溶解度曲线解决相关的问题,从而加深学生对固体溶解度的理解和掌握.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目