题目内容
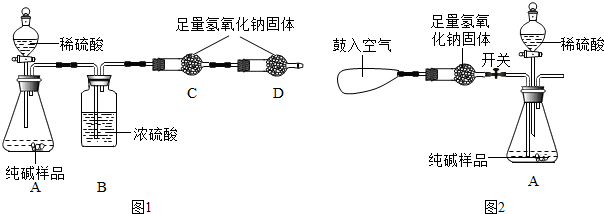
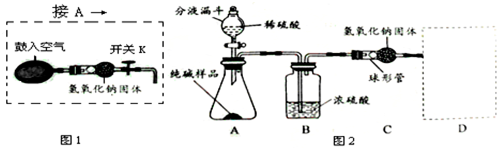
某品牌纯碱中含有少量氯化钠。某化学探究小组为了测定该品牌纯碱的纯度(即碳酸钠的质量分数),组内一同学设计如图所示实验:

(1)A装置中反应的化学方程式为 。
(2)B装置的作用是 ;C装置中反应的化学方程式为 。
(3) D装置的作用是 。
(4)小明提出能否用盐酸代替硫酸?同学们经过讨论认为不能,理由是 。
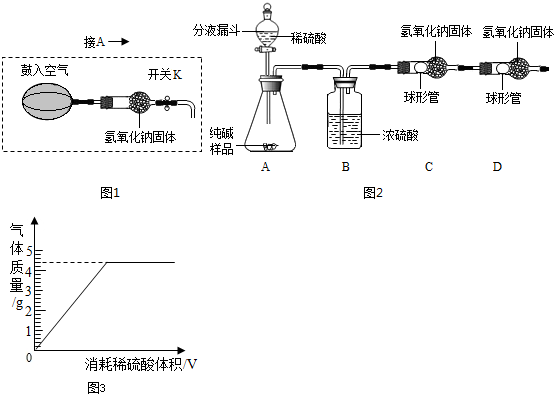
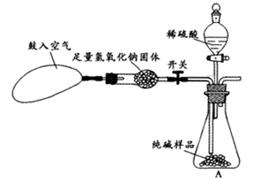
(5)小华提出,要使测定结果更准确,应把A装置改成图15所示装置,并在反应前鼓入空气,其目的是_____________________;反应后还要鼓入空气,其目的是_____________________.
(6)称得纯碱样品的质量为12.0 g,实验前、后C装置(包含药品)的质量分别为61.2 g和65.6 g,则该纯碱样品的纯度为 %(精确到0.1%)。
(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
(2)除去水蒸气 2NaOH + CO2 = Na2CO3+ H2O
(3)防止空气中二氧化碳、水蒸气进入C装置
(4)盐酸挥发出氯化氢气体被装置C吸收,影响实验测定
(5)排出装置中二氧化碳 使生成的二氧化碳全部鼓入C装置
(6) 88.3
【解析】
试题分析:(1)A装置中为稀硫酸和碳酸钠的反应,生成硫酸钠、水和二氧化碳;(2)C装置中盛的是浓硫酸,目的是吸收水蒸气,C装置中氢氧化钠的作用是吸收二氧化碳;(3)D装置的中氢氧化钠的作用是吸收空气中的水蒸气和二氧化碳,防止进入装置造成误差;(4)不可用稀盐酸,盐酸挥发出氯化氢气体被装置C吸收,影响实验测定;(5)A装置的缺点是产生的二氧化碳会有一部分残留在A装置中,所以反应前鼓入空气是为了排出装置中二氧化碳,反应后鼓入空气是为了使生成的二氧化碳全部鼓入C装置;
(6)设纯碱样品中碳酸钠的质量为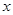 ,
,
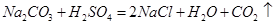
106 44
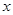 65.6g-61.2g
65.6g-61.2g
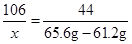 ,解得
,解得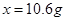
则该纯碱样品的纯度为88.3%.
考点:探究纯碱的成分
点评:这是一道非常典型的探究题,题目给的知识点没有学过,较为陌生,但是重点考察的反应的思想,装置等,所以这种题目不要害怕,仔细审题即可。

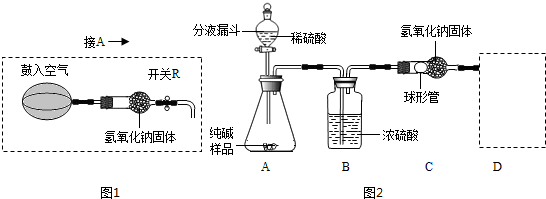
 (2013?闵行区二模)某品牌纯碱中含有少量氯化钠.化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),利用右图装置进行实验测定.
(2013?闵行区二模)某品牌纯碱中含有少量氯化钠.化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),利用右图装置进行实验测定.