题目内容
如右图是某校化学实验室从化学试剂商店买回的硫酸试剂瓶所贴标签上的部分内容,请你阅读后计算:
(1)此瓶所盛液体(未开启前)的质量为______g,其中溶质的质量为______g.
(2)欲配制500g溶质的质量分数为19.6%的稀硫酸,需用这种硫酸______mL.(结果保留一位小数)
(3)把(2)中配制成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?

(1)此瓶所盛液体(未开启前)的质量为______g,其中溶质的质量为______g.
(2)欲配制500g溶质的质量分数为19.6%的稀硫酸,需用这种硫酸______mL.(结果保留一位小数)
(3)把(2)中配制成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?

(1)根据标签信息,溶液体积为500mL,密度为1.84g/mL,溶质的质量分数为98%,
溶液质量=500mL×1.84g/mL=920g,溶质质量=920g×98%=901.6g;
(2)溶液稀释前后溶质质量不变,溶质的质量=500g×19.6%=98g,需要这种硫酸的体积=98g÷1.84g/mL÷98%≈54.3mL;
(3)由反应方程式:Zn+H2SO4═ZnSO4+H2↑,可知,98g硫酸与足量锌反应生成2g氢气.
98 2
故答案为:
(1)920;901.6;(2)54.3;(3)2g.
溶液质量=500mL×1.84g/mL=920g,溶质质量=920g×98%=901.6g;
(2)溶液稀释前后溶质质量不变,溶质的质量=500g×19.6%=98g,需要这种硫酸的体积=98g÷1.84g/mL÷98%≈54.3mL;
(3)由反应方程式:Zn+H2SO4═ZnSO4+H2↑,可知,98g硫酸与足量锌反应生成2g氢气.
98 2
故答案为:
(1)920;901.6;(2)54.3;(3)2g.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
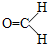 ,则其化学式为______,其碳、氢和氧元索的最简质量比为______,其含氧元素的质量分数等于______.
,则其化学式为______,其碳、氢和氧元索的最简质量比为______,其含氧元素的质量分数等于______.
