题目内容
【题目】(7分)现有一包白色固体样品,可能含有BaCl2、Na2SO4、Na2CO3、NH4HCO3、KCl、CuSO4中的一种或几种,取样品进行如下实验:
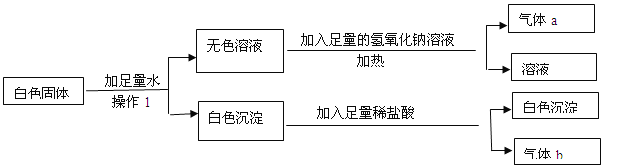
(1)操作1所用到是玻璃仪器有 。
(2)原白色固体中一定不含有 ,一定含有 。
(3)写出生成气体a的化学方程式 。
【答案】(1)玻璃棒、漏斗、烧杯;
(2)硫酸铜; 氯化钡、硫酸钠、碳酸钠、碳酸氢铵;
(3)2NaOH+NH4HCO3==Na2CO3+NH3↑+2H2O
【解析】
试题分析:(1)操作1为过滤操作,故所用到是玻璃仪器有)玻璃棒、漏斗、烧杯;根据题中的流程图可知,(2)原白色固体中一定不含有硫酸铜,因为溶于水后溶液显无色;一定含有氯化钡、硫酸钠、碳酸钠、碳酸氢钠,因为无色溶液加如氢氧化钠溶液有气体,说明一定有碳酸氢铵;沉淀加入盐酸部分溶解说明沉淀为碳酸钡和硫酸钡的的混合物;故一定含有氯化钡、碳酸钠、硫酸钠;(3)生成气体a的化学方程式2NaOH+NH4HCO3==Na2CO3+NH3↑+2H2O。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目