题目内容
【题目】小华所在的化学兴趣小组同学,在学习燃料的合理利用与开发后,对“天然气的主要成分甲烷燃烧后的气体产物是什么”产生了兴趣。他们在老师的指导下进行探究,请你参与探究并回答下列问题:
(提出问题)甲烷燃烧后生成哪些气体物质?
(查阅资料)①含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;②白色无水硫酸铜粉末遇水变蓝色。
(猜想假设)猜想Ⅰ:CO2、H2O;猜想Ⅱ:CO、H2O;猜想Ⅲ:_____。
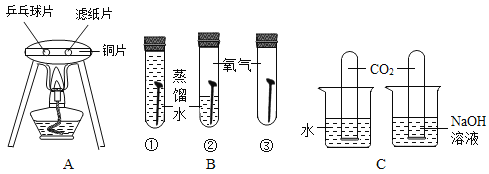
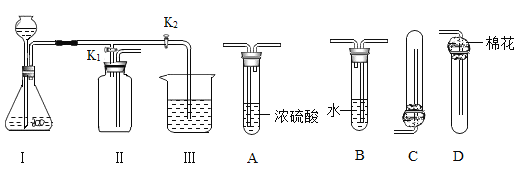
(实验设计)将甲烷在一定量纯净氧气中燃烧的产物依次通过A~E装置(部分夹持、固定装置省略)进行实验:
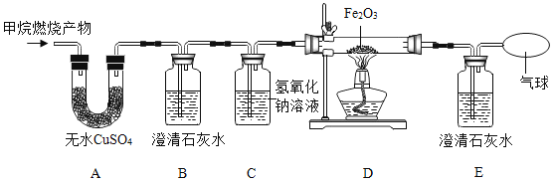
观察到的现象:①A中白色粉末变为蓝色;②B、E中澄清石灰水变浑浊;③D中红棕色粉末变成黑色。
(实验结论)根据以上实验现象可推断出猜想_____成立。
(反思交流)(1)装置B的作用是鉴别是否有_____生成,其中发生反应的化学方程式为_____;装置C的作用是_____。
(2)实验过程中用纯净的氧气而不用空气的原因是空气中含有_____,影响实验结果。
(实验改进)小明认为图示实验装置有缺陷,还应该在C、D装置之间增加一个装有澄清石灰水的洗气瓶。请你帮小明说明理由:_____。
(拓展延伸)日常生活中使用含碳燃料时,请你说出一条防止一氧化碳中毒的方法:_____。
【答案】CO2、CO、H2O Ⅲ 二氧化碳 CO2+Ca(OH)2=CaCO3↓+H2O 吸收二氧化碳 水蒸气和二氧化碳 检验二氧化碳是否被完全吸收 开窗通风,保持空气流通
【解析】
[猜想假设]根据质量守恒定律,甲烷分子式为CH4,与O2反应,则生成物为碳氧化合物、氢氧化合物,所以生成物为CO或CO2、H2O,当氧气足量,则生成CO2、H2O,当氧气少量,则生成CO、H2O,而当氧气适量时,甲烷部分完全燃烧,部分不完全燃烧,则生成物就为CO、CO2、H2O的混合物,所以除了上述两个猜想外,猜想Ⅲ则为三者混合物;故填:CO2、CO、H2O。
[实验结论]①中硫酸铜变蓝色,说明有水蒸气存在,②澄清石灰水变浑浊说明有二氧化碳存在,③红棕色氧化铁被还原为黑色固体铁,说明有一氧化碳存在,将氧化铁还原,根据三个实验现象推断生成物中有CO2、CO、H2O,所以猜想Ⅲ成立;故填:Ⅲ。
[反思交流](1)澄清石灰水与二氧化碳生成碳酸钙沉淀,可使石灰水变浑浊,是二氧化碳重要性质,所以用澄清石灰水作为检验二氧化碳的试剂使用,同时二氧化碳可被氢氧化钠吸收,避免混入一氧化碳,对后面实验造成影响;故填:二氧化碳;CO2+Ca(OH)2=CaCO3↓+H2O;吸收二氧化碳。
(2)实验是为了验证甲烷可以与氧气反应生成二氧化碳和水,如果用空气进行燃烧反应,那空气中的二氧化碳与水也可以发生上述的实验现象,不足以证明甲烷与氧气反应可以生成二氧化碳和水;故填:水蒸气和二氧化碳。
[实验改进]由于二氧化碳的生成量未知,同时加入氢氧化钠溶液的量是否能把二氧化碳全部吸收也未知,而在C、D之间加入一个澄清石灰水的洗气瓶后,可以通过观察澄清石灰有无变浑浊现象,判断二氧化碳是否还有残存。故填:检验二氧化碳是否被完全吸收。
[拓展延伸]根据上述实验可知,含碳燃料在氧气充足的情况下,不会产生一氧化碳,所以给予充足的氧气,可以有效避免一氧化碳生成,最简单方法就是增加空气流动,保证氧气的充足;故填:开窗通风,保持空气流通。