题目内容
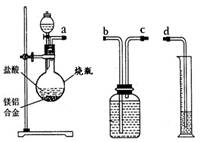
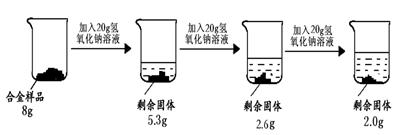
为测定某镁铝合金中铝的含量,设计了以下甲、乙两种方案.
甲方案:(查阅资料,Al(OH)3既可以与酸也可以与碱反应生成可溶性的盐和水)
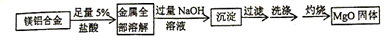
通过称量合金和灼烧后MgO固体的质量可以计算合金中铝的含量.请完成25~28题.
配置5%的盐酸1L(ρ=1.025g/cm3),需取用36.5%(ρ=1.181g/cm3)的盐酸
甲方案:(查阅资料,Al(OH)3既可以与酸也可以与碱反应生成可溶性的盐和水)
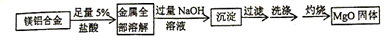
通过称量合金和灼烧后MgO固体的质量可以计算合金中铝的含量.请完成25~28题.
- A.118.9mL
- B.125.0mL
- C.115.1mL
- D.819.8mL
A
分析:根据溶质质量分数公式进行计算,溶液的体积需要转化成质量,稀释溶液,溶质质量不变,据此解答即可.
解答:稀释盐酸时,溶液中所含有的溶质质量不变,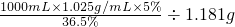 /mL≈118.9mL,观察选项,故选A.
/mL≈118.9mL,观察选项,故选A.
点评:本题考查了关于溶质质量分数的有关计算,完成此题,可以依据溶质质量分数公式进行.要注意进行体积和质量间的转化.
分析:根据溶质质量分数公式进行计算,溶液的体积需要转化成质量,稀释溶液,溶质质量不变,据此解答即可.
解答:稀释盐酸时,溶液中所含有的溶质质量不变,
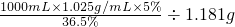 /mL≈118.9mL,观察选项,故选A.
/mL≈118.9mL,观察选项,故选A.点评:本题考查了关于溶质质量分数的有关计算,完成此题,可以依据溶质质量分数公式进行.要注意进行体积和质量间的转化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目