题目内容
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳.Ⅰ.(1)形状大小相同的铝和镁,分别放入同样的盐酸溶液中,下列说法不正确的是______(填序号).
A.两者都发生反应 B.镁比铝反应剧烈 C.铝不与盐酸溶液反应
(2)镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaAlO2表示)和H2,写出该反应的化学方程式:______.
Ⅱ.三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数.
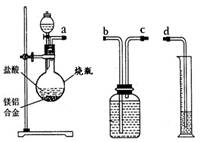
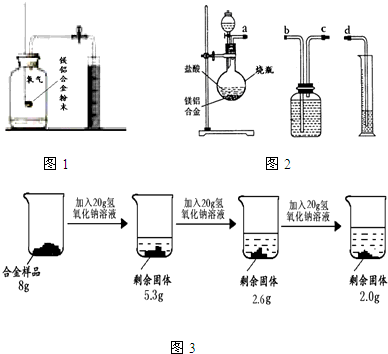
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积.如图1所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹.参与反应的氧气体积与______相等.
方案二:铝镁合金与盐酸反应,测定生成气体的体积.装置如图2所示.
(1)通过排水法测定所收集到的氢气体积,装置导管口a、b、c、d的连接顺序是:a→______→______→______
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果______(填“有”或“没有”)影响.
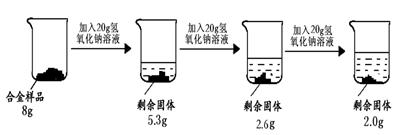
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量.称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图3:

(1)实验中所加的氢氧化钠溶液应过量,其目的是______.
(2)从上图数据可知,该合金中镁元素与铝元素的质量比为______.
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定______体积,也可得出合金中铝的质量.
【答案】分析:Ⅰ.(1)根据镁和铝都和盐酸反应但金属镁比铝活泼进行解答;
(2)根据铝和氢氧化钠溶液反应生成偏铝酸钠和氢气进行解答;
Ⅱ方案一:根据氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气进行解答;
方案二:(1)根据氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积进行解答;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)根据剩余固体的质量为金属镁的质量进行解答;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
解答:解:Ⅰ.(1)镁和铝都和盐酸反应但金属镁比铝活泼,所以镁比铝反应剧烈,故选C;
(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,该反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ方案一:氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气;
方案二:(1)氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积,所以装置导管口a、b、c、d的连接顺序是:a→c→b→d;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)剩余固体的质量为金属镁的质量,所以镁的质量为2g,铝的质量为8g-2g=6g,所以该合金中镁元素与铝元素的质量比为2g:6g=1:3;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
故答案为:Ⅰ.(1)C;
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ.方案一 量筒内水减少的体积;
方案二(1)c→b→d;
(2)无;
方案三(1)使镁铝合金中的铝完全反应; (2)1:3;
【反思与拓展】氢气.
点评:解答本题要掌握合金的含义及其各种合金的组成方面的知识,只有这样才能对相关方面的问题做出正确的判断.
(2)根据铝和氢氧化钠溶液反应生成偏铝酸钠和氢气进行解答;
Ⅱ方案一:根据氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气进行解答;
方案二:(1)根据氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积进行解答;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)根据剩余固体的质量为金属镁的质量进行解答;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
解答:解:Ⅰ.(1)镁和铝都和盐酸反应但金属镁比铝活泼,所以镁比铝反应剧烈,故选C;
(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,该反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ方案一:氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气;
方案二:(1)氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积,所以装置导管口a、b、c、d的连接顺序是:a→c→b→d;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)剩余固体的质量为金属镁的质量,所以镁的质量为2g,铝的质量为8g-2g=6g,所以该合金中镁元素与铝元素的质量比为2g:6g=1:3;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
故答案为:Ⅰ.(1)C;
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ.方案一 量筒内水减少的体积;
方案二(1)c→b→d;
(2)无;
方案三(1)使镁铝合金中的铝完全反应; (2)1:3;
【反思与拓展】氢气.
点评:解答本题要掌握合金的含义及其各种合金的组成方面的知识,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目