题目内容
为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88的质量分数,取10g样品放在烧杯中,将50g稀盐酸分若干次加入烧杯中,记录反应过程的质量关系如图所示.
(1)当消耗盐酸质量为______g时恰好完全反应;此时生成气体______g.
(2)10g样品中碳酸钙的质量分数是多少?
(3)所用稀盐酸中溶质的质量分数是多少?

【答案】分析:由图可知最后生成二氧化碳的质量为2.64g,所以根据反应的化学方程式,由放出二氧化碳的质量计算样品中碳酸钙的质量,即可求得样品中碳酸钙的质量分数以及所用稀盐酸中溶质的质量分数.
解答:解:(1)由图可知最后生成二氧化碳的质量为2.64g,此时消耗盐酸的质量为30g.
(2)设碳酸钙样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.64g
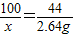
x=6g
10g样品中碳酸钙的质量分数= =60%
=60%
答:10g样品中碳酸钙的质量分数为60%.
(3)设30g 稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
y 2.64g

y=4.38g
所用稀盐酸中溶质的质量分数= ×100%=14.6%
×100%=14.6%
答:所用稀盐酸中溶质的质量分数是14.6%.
故答案为:
(1)30g;2.64g;
(2)60%;(3)14.6%.
点评:利用质量守恒定律,分析每次加入稀盐酸后烧杯及烧杯内物质总质量的变化,可以得出每次实验加入稀盐酸所放出二氧化碳的质量,据此对反应情况进行判断.
解答:解:(1)由图可知最后生成二氧化碳的质量为2.64g,此时消耗盐酸的质量为30g.
(2)设碳酸钙样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.64g
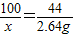
x=6g
10g样品中碳酸钙的质量分数=
 =60%
=60%答:10g样品中碳酸钙的质量分数为60%.
(3)设30g 稀盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
y 2.64g

y=4.38g
所用稀盐酸中溶质的质量分数=
 ×100%=14.6%
×100%=14.6%答:所用稀盐酸中溶质的质量分数是14.6%.
故答案为:
(1)30g;2.64g;
(2)60%;(3)14.6%.
点评:利用质量守恒定律,分析每次加入稀盐酸后烧杯及烧杯内物质总质量的变化,可以得出每次实验加入稀盐酸所放出二氧化碳的质量,据此对反应情况进行判断.

练习册系列答案
相关题目
 为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88
为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88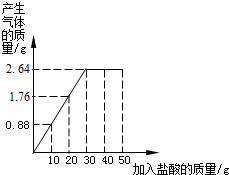 为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88
为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88