题目内容
【题目】为了探究金属性质,某实验小组进行了如下实验:
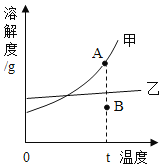
(1)探究金属与酸反应的规律,某实验小组进行了如下实验:取等质量、同形状的铁片镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如图所示。
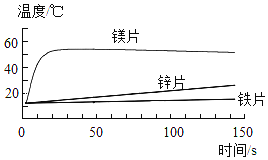
①请分析反应中温度升高的原因:_______。
②根据曲线总结出金属活动性的相关规律_______。
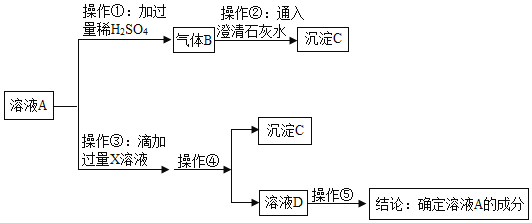
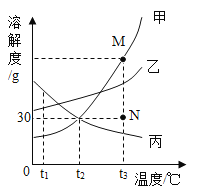
(2)探究金属与某些盐溶液反应的规律,实验如下:向一定量的硝酸银和硝酸铜混合溶液中逐渐加入锌粉。绘制的溶液中溶质种类与加入锌的质量关系如图所示。
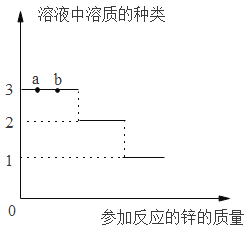
①向滤液中插入铁丝,铁丝表面无明显变化,过滤后滤渣中的成分有______。
②a、b两点,溶液的质量a____b(填“=”、“<”或“>”)
【答案】金属与酸反应放出热量 相同条件下,金属越活泼,与酸反应放出的热量越多(必须指明条件相同) 一定有银和铜,可能有锌 >
【解析】
(1)①反应过程中温度升高的原因:金属与酸反应放出热量。
②根据曲线可知,金属活动性的相关规律:相同条件下,金属越活泼,与酸反应放热越多。
(2)①向滤液中插入铁丝,铁丝表面无明显变化,说明溶液中没有硝酸银和硝酸铜,说明金属银和铜被完全置换出来,锌可能恰好反应也可能过量,过滤后滤渣中的成分为一定有银和铜,可能有锌;
②由题意可知,a、b两点发生的是锌和硝酸银的反应,锌和硝酸银反应的化学方程式及其质量关系为:
![]()
由以上质量关系可知,锌和硝酸银反应后溶液质量减小,所以溶液的质量a>b。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】铜、铝两种金属的抗腐蚀性都比较优良。兴趣小组分工协作进行探究。
[查阅资料]:常温下,铝不与水发生反应;硫酸铝、氯化铝溶液为无色。
活动一:探究铝的抗腐蚀性优良的原因。
如图所示,将铝条在酒精喷灯上灼烧,发现熔化了的铝并未掉下来,被包裹在一个“小袋子”中,下面实验分析正确的是_____。

A 氧化铝的熔点比铝高
B “小袋子”是致密的氧化铝薄膜
C 铝的化学性质不活泼
活动二:验证铝与铜的金属活动性。
[选择药品]:I铝条和硫酸铜溶液;II_____, 两组药品都可以完成实验目的。
[进行实验]:同学们选择I中药品进行实验
操作步骤 | 实验现象 | 分析与结论 |
取一支洁净的试管,注入少量的硫酸铜溶液,放入铝条。 | 无明显现象 | 现象与理论不符,同学们讨论,发现了问题,重新改进该实验。 |
改进实验:取一支洁净的试管, 注入少量的硫酸铜溶液,_____。 | _____ | 铝比铜活泼。反应化学方程式为_____。 |
[发现问题]:在该实验中发现铝条表面出现少量气泡,经查阅气体为氢气。产生该现象可能的原因是_____。