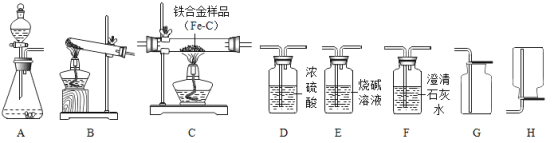
题目内容
【题目】某同学在实验室发现了一瓶敞口放置的过氧化氢溶液,其上的标签是10%,他认为该溶液中溶质的质量分数可能不到10%,需要重新测定并更换试剂瓶的标签。他做了如下实验:称量该溶液34.0g倒入烧杯中,然后向其中加入0.5g二氧化锰,直到不再放出气体后,再称量烧杯中混合物的质量,称量结果为33.7g。
(1)该溶液溶质的质量分数减小的理由是_____。
(2)反应生成的气体的质量为_____。
(3)计算该瓶溶液中溶质的实际质量分数_____。
【答案】过氧化氢在常温下能缓慢分解成水和氧气 0.8g 5%
【解析】
(1)该溶液溶质的质量分数减小的理由是溶液中过氧化氢在常温下能缓慢分解成水和氧气.故答案为:过氧化氢在常温下能缓慢分解成水和氧气;
(2)二氧化锰的质量是0.5g,则生成的气体的质量为:34.0g+0.5g-33.7g=0.8g;故填:0.8g;
(3)设产生0.8g氧气需要过氧化氢的质量为x

x=1.7g
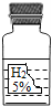
此过氧化氢溶液中溶质的质量分数为![]() ×100%=5%
×100%=5%
答:该过氧化氢溶液中溶质的质量分数为5%.

 阅读快车系列答案
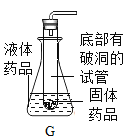
阅读快车系列答案【题目】实验室中有一瓶标签受损的无色液体,如图所示。这瓶无色液体是什么呢? 某化学小组的学生进行了讨论
(1)大家讨论后一致认为不可能是蒸馏水,请说出理由是_____。
实验操作 | 实验现象 | 实验结论 |
步骤一:取该液体适量于试管中,向其中加入少量_____粉末。 | 没有气泡产生。 | 该液体不是过氧化氢溶液。 |
步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | _____ | 该液体是稀硫酸。 |
(2)如果该液体可以用来制取氧气,写出反应的方程式_____。
(3)甲同学测定该液体能使紫色的石蕊试液变红,则该液体可能是_____(写一种符合条件的化学式)。
(4)吸附剂中主要物质为SiO2和CaCl2, CaCl2中钙、氯元素的质量比为_____。
【题目】在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物 质 | X | Y | Z | W |
反应前的质量(g) | 20 | m | 16 | 14 |
反应后的质量(g) | 4 | 6 | 60 | 50 |
下列关于此反应的认识,正确的是( )
A.m的数值为64
B.Z和W的相对分子质量之比为11:9
C.参加反应的X与Y的质量比为1:4
D.若X为化合物,Y为单质,则该反应一定为置换反应