题目内容
复习时,常用专题的探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个探究实验.(1)探究1:研究常见物质性质-氢氧化钠与盐酸是否刚好完全中和.
①探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现pH<7,说明盐酸过量.
②验证:
| 实验内容 | 实验现象 | 解释与结论 |
| 取少量溶液于试管中, | 证明研究结论正确 |
(2)探究2:研究常见物质的制取-制取氢氧化钠溶液.
甲同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
乙同学却说:“这种无色溶液不一定含有氢氧化钠”他提出了如下实验:
| 实验内容 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴酚酞试液 | 无色酚酞变红 | 无色溶液中有氢氧化钠 |
丙同学设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 无色溶液中确实含有氢氧化钠 |
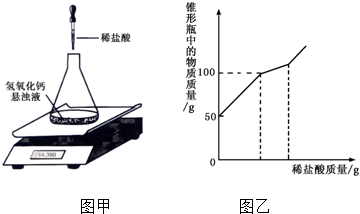
(3)经过实验发现,某同学取53g 10%的碳酸钠溶液与152g饱和澄清石灰水恰好完全反应,求反应后溶液中溶质的质量分数.
分析:对于探究1,根据题干中的信息,我们在做题时主要考虑盐酸的化学性质,来证明盐酸的存在.
对于探究2,我们要考虑到碳酸钠的水溶液呈碱性,在验证氢氧化钠的存在时要排除碳酸钠的干扰
探究2 中的最后一问在计算时要注意反应后溶液质量的求法:m后=反应前加入的物质的质量总和-不溶的杂质的质量-生成的沉淀的质量-生成的气体的质量
对于探究2,我们要考虑到碳酸钠的水溶液呈碱性,在验证氢氧化钠的存在时要排除碳酸钠的干扰
探究2 中的最后一问在计算时要注意反应后溶液质量的求法:m后=反应前加入的物质的质量总和-不溶的杂质的质量-生成的沉淀的质量-生成的气体的质量
解答:解(1)由题中pH<7,盐酸过量,要验证盐酸过,考虑到盐酸的化学性质能和活泼金属反应生成氢气,现象明显,
所以向其中加入锌粒来验证盐酸的存在.故答案为:①加入锌粒 有气泡产生 ②Zn+2HCl=ZnCl2+H2↑(答案合理即可)
(2)根据题意可知,碳酸钠溶液时过量的,而碳酸钠溶液呈碱性,乙同学没有考虑到这一点,所以他的实验方案不够严密.
故答案为:碳酸钠溶液也能能使酚酞变红(或碳酸钠溶液也是碱性的)
(3)要证明甲同学的结论正确,就应该先排除碳酸钠的干扰,然后进行验证氢氧化钠的存在,所以我们应该先除去碳酸钠,除去碳酸钠的方法有很多种,常用的方法的就是把它转化为沉淀或者是气体.
故答案为:取少量溶液,向其中加入适量的BaCl2溶液,过滤,然后向滤液中加入酚酞(其他合理答案也可)
没有证明氢氧化钠生成 排除了碳酸钠的干扰 证明了氢氧化钠的存在
(4)解:设生成的氢氧化钠质量为x,生成的碳酸钙的质量为y.
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 100 80
53g×10% y x
=5.3g
=
=
解得 x=4g y=5g
ωNaOH=
×100%=2%
答:反应后所得溶液的质量分数为2%.
所以向其中加入锌粒来验证盐酸的存在.故答案为:①加入锌粒 有气泡产生 ②Zn+2HCl=ZnCl2+H2↑(答案合理即可)
(2)根据题意可知,碳酸钠溶液时过量的,而碳酸钠溶液呈碱性,乙同学没有考虑到这一点,所以他的实验方案不够严密.
故答案为:碳酸钠溶液也能能使酚酞变红(或碳酸钠溶液也是碱性的)
(3)要证明甲同学的结论正确,就应该先排除碳酸钠的干扰,然后进行验证氢氧化钠的存在,所以我们应该先除去碳酸钠,除去碳酸钠的方法有很多种,常用的方法的就是把它转化为沉淀或者是气体.
故答案为:取少量溶液,向其中加入适量的BaCl2溶液,过滤,然后向滤液中加入酚酞(其他合理答案也可)
没有证明氢氧化钠生成 排除了碳酸钠的干扰 证明了氢氧化钠的存在
(4)解:设生成的氢氧化钠质量为x,生成的碳酸钙的质量为y.
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 100 80
53g×10% y x
=5.3g
| 106 |
| 5.3g |
| 80 |
| x |
| 106 |
| 5.3g |
| 100 |
| y |
解得 x=4g y=5g
ωNaOH=
| 4g |
| 53g+152g-5g |
答:反应后所得溶液的质量分数为2%.
点评:本题为综合的实验探究题,我们应保持清晰的思路,认真研读题干中的信息,并联系相关物质的性质特别是化学性质来解答题目

练习册系列答案
相关题目