��Ŀ����
����Ŀ�������������壨FeC2O42H2O����һ��dz��ɫ���壬������ˮ�������ֽ⣬������﮵�ص�ԭ���ϣ�ij��ѧ��ȤС�����ʵ����֤�������������ȷֽ���������������ط���TG��ȷ����ֽ�����ù���������ɣ�̽���������£� ���������ϡ�
�١��������������ȷֽ�����������H2O��CO��CO2
�ڡ���ɫ����ˮCuSO4��ˮ����������ɫ
��ʵ����ơ�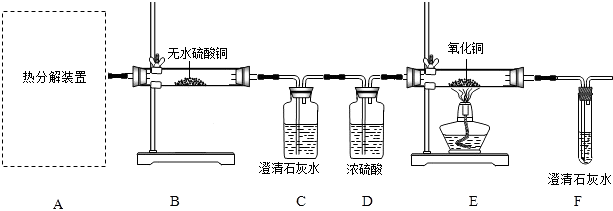
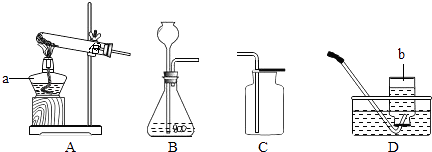
��1���ӻ����Ƕȿ��ǣ�����ʵ��װ�õ�����ȱ����
��2����ѡ������ʵ��װ���е���ѡ��ס����ҡ�����Ϊ�����еġ��ȷֽ�װ�á��� 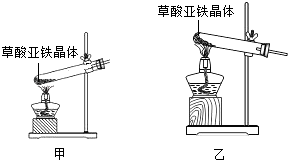
��3�����������ۡ� D��Ũ����������� �� ʵ������й۲쵽B�а�ɫ��ˮCuSO4�����ɫ��C�г���ʯ��ˮ����ǣ�E������ʵ���������֤���������������ȷֽ�����������H2O��CO��CO2 ��
��4������ȤС���������ʵ��ʱ���ȵ�ȼ�ȷֽ�װ���еľƾ��ƣ�һ��ʱ����ٵ�ȼE���ľƾ��ƣ�ԭ����
��5����ͨ��Fװ���г���ʯ��ˮ�������֤���������������ȷֽ�������������CO��������C��Dװ��֮������ʢ���������ʵ����ƻ�ѧʽ����Һ��ϴ��ƿ��
��6�������ݷ����� ��ȡ3.60g�����������壨FeC2O42H2O����Է���������180�������ط���������ȷֽ⣬�õ�ʣ�������������¶ȱ仯��������ͼ��ʾ���������ͼ�ش��������⣺
�ٹ��̢�����Ӧ�Ļ�ѧ����ʽΪ ��
��300��ʱʣ�����ֻ��һ�����������������ͨ������ȷ����������Ļ�ѧʽ������ �� ����д��������̣�
���𰸡�
��1��û�д���β��
��2����
��3���������壻��ɫ������ɫ
��4����װ���еĿ����ž�����ֹCO�Ϳ����Ļ���������ȱ�ը
��5��NaOH
��6��FeC2O4?2H2O ![]() FeC2O4+2H2O����Fe2O3
FeC2O4+2H2O����Fe2O3
���������⣺��1���ӻ����Ƕȿ��ǣ�����ʵ��װ�õ�����ȱ����û�д���β���� ���û�д���β������2�����ȷֽ�װ�á�Ӧ��ѡ����װ�ã�
����ң���3��D��Ũ����������Ǹ������壬ʵ������й۲쵽B�а�ɫ��ˮCuSO4�����ɫ��C�г���ʯ��ˮ����ǣ�E�к�ɫ������ɫ�����֤���������������ȷֽ�����������H2O��CO��CO2 ��
����������壻��ɫ������ɫ����4����������ʵ��ʱ���ȵ�ȼ�ȷֽ�װ���еľƾ��ƣ�һ��ʱ����ٵ�ȼE���ľƾ��ƣ�ԭ���ǣ���װ���еĿ����ž�����ֹCO�Ϳ����Ļ���������ȱ�ը��
�����װ���еĿ����ž�����ֹCO�Ϳ����Ļ���������ȱ�ը����5����ͨ��Fװ���г���ʯ��ˮ�������֤���������������ȷֽ�������������CO��Ӧ�ðѷֽ����ɵĶ�����̼������ֻҪ��C��Dװ��֮������ʢ��NaOH��Һ��ϴ��ƿ���ɣ�
���NaOH����6����ͨ��ʣ������������֪�����̢����ķ�Ӧ�ǣ�����������������ʧȥ�ᾧˮ����Ӧ�Ļ�ѧ����ʽΪ��FeC2O42H2O ![]() FeC2O4+2H2O����
FeC2O4+2H2O����
���FeC2O42H2O ![]() FeC2O4+2H2O�����ڲ������������е���Ԫ������Ϊ��3.6g��
FeC2O4+2H2O�����ڲ������������е���Ԫ������Ϊ��3.6g�� ![]() ��100%=1.12g���������������е���Ԫ����ȫת�����������У�
��100%=1.12g���������������е���Ԫ����ȫת�����������У�
����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��Ԫ�غ���Ԫ�ص�������Ϊ��1.12g��0.48g=7��3��
������������Ļ�ѧʽΪFexOy ��
����56x��16y=7��3��
x��y=2��3��
����������Ļ�ѧʽΪFe2O3 ��
���Fe2O3 ��
�����㾫�������չ�����ȵ�ע�������һ����̼�������ǽ����ĸ�������Ҫ֪�����ȹ���ʱ���Թܿ�Ӧ������б���Թ�����ʱ�Ⱦ������ȣ��ټ��м��ȣ�һ����̼���������ʣ���ɫ����ζ�����壬�ܶȱȿ�����С��������ˮ��һ����̼�Ļ�ѧ���ʣ���ȼ�Ժͻ�ԭ�ԣ�

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�