题目内容
【题目】(13分)通过化学学习,你已经掌握了实验室制取气体的有关知识,回答问题:
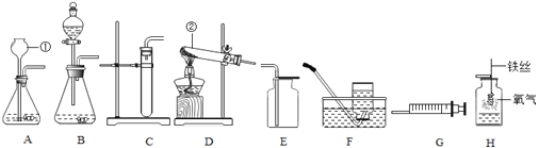
(1)请写出上图中标号仪器的名称:① ;② 。
(2)实验室用锌粒和稀硫酸来制取2瓶纯净的氢气时,要求能随时控制生成气体的速率并节约药品,应选用发生装置 收集装置 进行组合。该反应的化学方程式为: 。
(3)实验室用高锰酸钾制取氧气时,发生装置应选用 (填编号);该反应的化学方程式为: 。如用E装置收集O2,检验O2是否收集满的方法是 。
(4)注射器G可用于检查装置A的气密性,步骤如下:
①向锥形瓶中加入少量水至 处。
②将注射器C连接到装置A的导管口处。
③缓慢拉动注射器G的活塞,观察到 ,表示装置A的气密性良好。
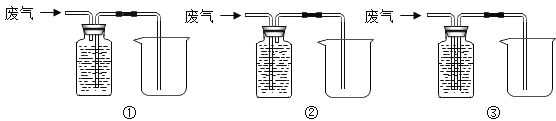
(5)某同学设计的除去C0中的少量的C02并收集一瓶C0的装置如下图(瓶内为澄清石灰水), 其中最合理的装置是_ 。
【答案】(1)①长颈漏斗;②试管;
(2)BF;Zn+H2SO4═ZnSO4+H2↑;
(3)D;2KMnO4![]() K2MnO4+MnO2+O2↑;将带火星的木条放在瓶口,如复燃,则满;
K2MnO4+MnO2+O2↑;将带火星的木条放在瓶口,如复燃,则满;
(4)①浸没长颈漏斗下端管口;③长颈漏斗下端管口有气泡产生,表示装置A的气密性良好。
(5)③。
【解析】
试题分析:(1)长颈漏斗方便加液体药品,试管是常用的反应容器,故答案为:①长颈漏斗;②试管;
(2)实验室用锌粒和稀硫酸来制取2瓶纯净的氢气时,要求能随时控制生成气体的速率并节约药品,应选用发生装置B;收集装置F进行组合。该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;故答案为:BF;Zn+H2SO4═ZnSO4+H2↑;
(3)如果用高锰酸钾制氧气就需要加热,发生装置应选用D;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;如用E装置收集O2,检验O2是否收集满的方法是将带火星的木条放在瓶口,如复燃,则满;
K2MnO4+MnO2+O2↑;如用E装置收集O2,检验O2是否收集满的方法是将带火星的木条放在瓶口,如复燃,则满;
(4)注射器G可用于检查装置A的气密性:向锥形瓶中加入少量水至浸没长颈漏斗下端管口处,将注射器C连接到装置A的导管口处,缓慢拉动注射器G的活塞,观察到 长颈漏斗下端管口有气泡产生,表示装置A的气密性良好,故答案为:①浸没长颈漏斗下端管口;③长颈漏斗下端管口有气泡产生,表示装置A的气密性良好;
(5)利用洗气瓶来除去二氧化碳并收集一氧化碳气体时,应长管进气;同时要收集CO,应该是长管出,才能将液体排尽,所以两个管都应该通到底部;故最合理的装置是③。

【题目】(11分)某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气。根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐。
【猜想与假设】
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的 加快了H2O2的溶液分解。
【设计方案和实验】完成下列表格
实验方案 | 实验现象 | 结论 |
方案一:向盛有10mL 5% H2O2溶液的试管中加入2g 氧化铁粉末,将一根带火星的木条放在试管口,观察现象。 | 甲同学结论成立。 | |
方案二:向盛有10mL 5% H2O2溶液的试管中加入 粉末,将一根带火星的木条放在试管口,观察现象。 | 无现象 | 乙同学结论 。 (填“成立”或“不成立”) |
【讨论交流】丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂。你是否支持丙同学的观点? ,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是 。
【拓展】
(1)实验证明Fe2O3粉末可以作为H2O2分解的催化剂。该反应的文字表达式
(2)下表是丙同学探究影响H2O2分解速率时所记录的部分数据,通过对数据分析,你能得出什么结论? 。
用足量等体积H2O2溶液制取相同体积O2所需的时间:






