题目内容
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
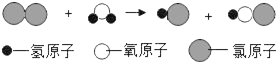
(假设)H2O2生成O2的快慢与催化剂种类有关
(实验方案)常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
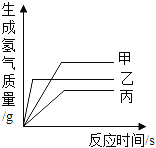
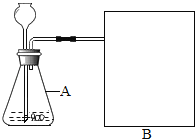
(进行实验)如图是他们进行实验的装置图,此实验中B处宜采用的气体收集方法是_____。
(实验记录)
实验编号 | 1 | 2 |
反应物 | 6% H2O2 | 6% H2O2 |
催化剂 | 1g 红砖粉 | 1g MnO2 |
时间 | 152s | 35s |
(结论)该探究过程得出的结论是_____。
(反思)H2O2在常温下分解缓慢,加入MnO2或 红砖粉后反应明显加快,若要证明MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____和_____是否改变。
H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出一种假设和实验方案)
(假设)_____。
(实验方案)_____。
【答案】排水法 H2O2生成O2的快慢与催化剂种类有关 质量 化学性质 H2O2生成O2的快慢与温度有关 在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2,一瓶放在常温,另一瓶放载40度水中加热,测量各生成一瓶(相同体积)O2所需要的时间
【解析】
[进行实验]要测量各生成一瓶(相同体积)O2所需要的时间,可以采用排水法收集氧气,故填:排水法;
[结论]根据表格提供的数据可以看出,H2O2生成O2的快慢与催化剂种类有关;故填:H2O2生成O2的快慢与催化剂种类有关;
[反思]要证明MnO2和红砖粉是该反应的催化剂,还需要证明它们的质量和化学性质在化学反应前后不变,故填:质量;化学性质;
[假设]可以假设过氧化氢的分解与反应的温度有关,故填:H2O2生成O2的快慢与温度有关;
[实验方案]要证明过氧化氢的分解与温度有关,可以在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2,一瓶放在常温,另一瓶放载40度水中加热,测量各生成一瓶(相同体积)O2所需要的时间。故填:在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2,一瓶放在常温,另一瓶放载40度水中加热,测量各生成一瓶(相同体积)O2所需要的时间。

【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:

(1)试管A中的现象是 ,反应后试管B中一定有的阳离子是 (写离子符号)。
(2)试管C中反应的化学方程式为 。小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl 、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想 一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |
【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
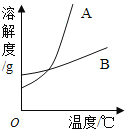
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
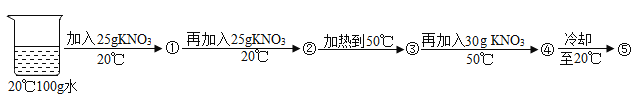
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。