题目内容
【题目】实验室常用石灰石(主要成分的化学式:CaCO3)与稀盐酸反应制取二氧化碳.某化学兴趣小组为了探究反应后废液中的成分,将废液过滤,取滤液40g于烧杯中,向其中滴加溶质质量分数为10.6%的碳酸钠溶液直到过量.有关变化如下图所示,根据题中有关信息和图象分析回答下列问题(石灰石中所含杂质不与稀盐酸反应,也不溶于水). 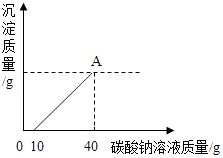
(1)CO2由种元素组成.
(2)每个CO2分子中含有碳、氧原子的个数比为 .
(3)CO2的相对分子质量是 .
(4)A点处生成沉淀的质量是g.
(5)计算A点处溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
【答案】
(1)两
(2)1:2
(3)44
(4)3
(5)解:设盐酸与碳酸钠反应生成的氯化钠的质量为m,生成的二氧化碳的质量为n
Na2CO3+2HCl= | 2NaCl+H2O+ | CO2↑, |
106 | 117 | 44 |
10g×10.6% | m | n |
![]()
解得:m=1.17g,n=0.44g
A点处溶液中溶质的质量分数: ![]() ≈6.1%
≈6.1%
【解析】解:(1)CO2由碳氧两种元素组成的(2)每个CO2分子中含有碳、氧原子的个数比为1:2.(3)CO2的相对分子质量是:12+16×2=44.(4)设氯化钙与碳酸钠反应生成了的碳酸钙的质量为x,生成氯化钠的质量为y
Na2CO3+CaCl2= | CaCO3↓+ | 2NaCl, |
106 | 100 | 117 |
(40g﹣10g)×10.6% | x | y |
![]()
解得:x=3g y=3.51g
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

 名校课堂系列答案
名校课堂系列答案【题目】区别下列各组物质,选用的方法或试剂不正确的是( )
物 质 | 选用的方法或试剂 | |
A | 空气和氧气 | 燃着的木条 |
B | 水和过氧化氢 | 二氧化锰 |
C | 氮气和二氧化碳 | 燃着的木条 |
D | 硬水和软水 | 肥皂水 |
A. A B. B C. C D. D