题目内容
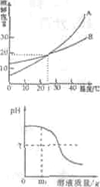
(5分)右图是a、b、c三种固体物质的溶解度曲线

(1) t2℃时,a、b、c三种物质中,溶解度最大的是 。
(2)a中混有少量b,用 的方法提纯a。
(3)t2℃时,将c物质的饱和溶液转变成不饱和溶液可采取的方法有 (写出一种即可)。
(4)t2℃时,75g a物质的饱和溶液降温到t1℃析出a物质 g(不含结晶水)。
(5)t1℃时,60ga物质的饱和溶液加入40g水稀释后溶液的溶质质量分数为 。

(1) t2℃时,a、b、c三种物质中,溶解度最大的是 。
(2)a中混有少量b,用 的方法提纯a。
(3)t2℃时,将c物质的饱和溶液转变成不饱和溶液可采取的方法有 (写出一种即可)。
(4)t2℃时,75g a物质的饱和溶液降温到t1℃析出a物质 g(不含结晶水)。
(5)t1℃时,60ga物质的饱和溶液加入40g水稀释后溶液的溶质质量分数为 。
(1)a;(2)冷却热饱和溶液(或“降温结晶”、“结晶”);(3)加溶剂或降温;(4)15;(5)10%。
本题考查的是固体溶解度曲线及其作用,饱和溶液和不饱和溶液,饱和溶液和不饱和溶液相互转化的方法,晶体和结晶的概念与现象。
根据固体的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,从而确定一定量的溶剂中溶解一定的溶质形成的溶液是否饱和,②判断出固体的溶解度随温度变化的变化情况,从而确定等质量的饱和溶液降温时析出的晶体的多少,及通过升温、降温还是蒸发溶剂的方法使不饱和溶液变成饱和溶液。
(1) t2℃时,a、b、c三种物质中,a的溶解度曲线在最上边,故溶解度最大。
(2)由溶解度曲线可知,a物质的溶解度随温度的升高而增大,b物质的溶解度受温度影响不大,故a中混有少量b,要用降温结晶的方法提纯a。
(3)由溶解度曲线可知,c物质的溶解度随温度的升高而减小,故将t2℃时的c物质的饱和溶液转变成不饱和溶液可采取的方法有加溶剂或降温。
(4)由溶解度曲线可知, t2℃时a物质的溶解度是50g,即此温度下,100g水中最多溶解50g溶质,则t2℃时,75g a物质的饱和溶液中有溶质25g,溶剂50g;降温到t1℃时,溶剂的质量不变,而t1℃时a物质的溶解度是20g,则50g水中只能溶解10g溶质,故析出a物质的质量为15g。
(5)t1℃时a物质的溶解度是20g,故t1℃时,60ga物质的饱和溶液中含有溶质10g,加入40g水稀释后,溶质质量不变,溶液质量变成100g,则溶液的溶质质量分数为10%。
根据固体的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,从而确定一定量的溶剂中溶解一定的溶质形成的溶液是否饱和,②判断出固体的溶解度随温度变化的变化情况,从而确定等质量的饱和溶液降温时析出的晶体的多少,及通过升温、降温还是蒸发溶剂的方法使不饱和溶液变成饱和溶液。
(1) t2℃时,a、b、c三种物质中,a的溶解度曲线在最上边,故溶解度最大。
(2)由溶解度曲线可知,a物质的溶解度随温度的升高而增大,b物质的溶解度受温度影响不大,故a中混有少量b,要用降温结晶的方法提纯a。
(3)由溶解度曲线可知,c物质的溶解度随温度的升高而减小,故将t2℃时的c物质的饱和溶液转变成不饱和溶液可采取的方法有加溶剂或降温。
(4)由溶解度曲线可知, t2℃时a物质的溶解度是50g,即此温度下,100g水中最多溶解50g溶质,则t2℃时,75g a物质的饱和溶液中有溶质25g,溶剂50g;降温到t1℃时,溶剂的质量不变,而t1℃时a物质的溶解度是20g,则50g水中只能溶解10g溶质,故析出a物质的质量为15g。
(5)t1℃时a物质的溶解度是20g,故t1℃时,60ga物质的饱和溶液中含有溶质10g,加入40g水稀释后,溶质质量不变,溶液质量变成100g,则溶液的溶质质量分数为10%。

练习册系列答案
相关题目