题目内容
【题目】鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:
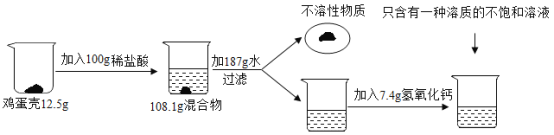
请回答下列问题:
(1)鸡蛋壳发生反应的化学方程式为_________________;
(2)根据已知条件列出求解碳酸钙质量(X)的比例式________________;
(3)该鸡蛋壳中碳酸钙的质量分数为______________;
(4)最终所得溶液中溶质的质量分数为_________________;
(5)用36.5%的浓盐酸配制上述稀盐酸需加水的质量为______________;
(6)配制上述稀盐酸过程中需要用到的仪器有烧杯、量筒、玻璃棒和__________________。
【答案】【答题空1】![]()
【答题空2】![]()
【答题空3】80%
【答题空4】7.4%
【答题空5】60g
【答题空6】胶头滴管
【解析】
鸡蛋壳的主要成分是碳酸钙,加入稀盐酸,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,混合物的质量减少,是因为有二氧化碳生成,加水、过滤,实现固液分离,加入氢氧化钙,得到只含一种溶质的不饱和溶液,说明碳酸钙与稀盐酸的反应,稀盐酸过量,加入的氢氧化钙恰好将过量的盐酸中和。
(1)鸡蛋壳的主要成分是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:![]() ;
;
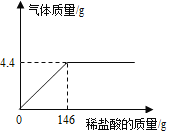
(2)生成二氧化碳的质量为:12.5g+100g-108.1g=4.4g
解:设碳酸钙的质量为X,生成氯化钙的质量为y,与碳酸钙反应的盐酸的质量为m
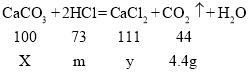
故求解碳酸钙质量的比例式为:![]() ,X=10g
,X=10g
![]() y=11.1g
y=11.1g
![]() m=7.3g
m=7.3g
(3)该鸡蛋壳中碳酸钙的质量分数为:![]() ;
;
(4)解:设7.4g氢氧化钙反应后生成氯化钙的质量为z,与氢氧化钙反应的盐酸的质量为n
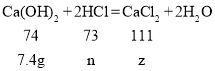
![]() z=11.1g
z=11.1g
![]() n=7.3g
n=7.3g
最终所得溶液中溶质的质量分数为:![]() ;
;
(5)解:设需要36.5%的浓盐酸的质量为w
36.5%×w=7.3g+7.3g,w=40g
需加水的质量为:100g-40g=60g;
(6)用浓溶液配制稀溶液,需要用到的仪器有:量筒(量取所需的溶液和水)、烧杯(混合)、玻璃棒(搅拌)、胶头滴管(吸取少量溶液),故填:胶头滴管。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】过氧化钠是钠在氧气或空气中燃烧的产物之一,纯品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,在空气中会吸收水和二氧化碳,易溶于水,与水发生反应生成氢氧化钠和过氧化氢,接着过氧化氢又能分解放出氧气。

(1)请写出过氧化钠与水反应的化学方程式:_________________。
(2)请写出区别水和过氧化氢的方法:_________________。
(3)某同学为了证明过氧化钠与水反应生成了氢氧化钠,在反应后的溶液中滴加几滴无色酚酞溶液,发现溶液变成了红色,可是过一会儿红色又消失了。
(提出问题)什么原因导致溶液先变红再褪为无色呢?
(猜想与假设)
猜想1:可能是无色酚酞溶液变质导致溶液褪色;
猜想2:可能是生成的过氧化氢使溶液褪色。
(实验与结论)
(4)猜想1立即遭到其他同学的质疑,理由是_________________。
(5)为了验证猜想2,同学们设计了如下实验方案:
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,滴加1~2滴无色酚酞溶液,溶液变红后再___________,观察现象 | 溶液由红色变为无色 | _______________________ |
(讨论交流)
(6)老师提醒同学们还有其他原因也会导致溶液先变红再褪为无色,你认为可能还与______________(写一条即可)有关。
【题目】小明同学在超市里看到“食用碱面”(如图1所示),他想知道该“食用碱面”的成分,请教老师后得知它的主要成分是一种钠盐。
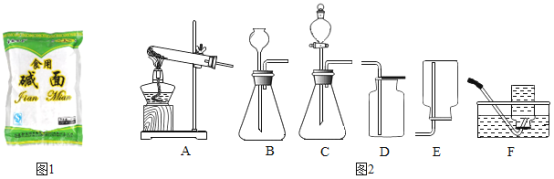
(作出猜想)小明及其他同学猜想其主要成分可能是:
①Na2SO4 ②NaCl ③Na2CO3 ④NaHCO3
(查阅资料)(1)氯化钡溶液与碳酸氢钠溶液不反应。
(2)碳酸氢钠溶液呈碱性。
小明与同学们进行如下实验来确认该“食用碱面”的主要成分。
(进行实验)取适量该“食用碱面”于试管中,加入蒸馏水使之完全溶解,把所得溶液分成两等份。
实验操作 | 实验现象 | 实验结论 |
实验①:在第一份溶液中加入氯化钡溶液 | _____ | 猜想①正确 |
实验②:在第二份溶液中加入_____ | 有气泡产生 | 猜想_____正确 |
(交流讨论)
(1)同学们经过讨论,发现仅仅通过实验①不能得出该“食用碱面”的主要成分是Na2SO4,也可能是Na2CO3,原因是_____(用化学方程式表示)。
(2)同学们通过对实验①②的分析得出该“食用碱面”的主要成分是Na2CO3,理由是_____。
(3)有同学认为把酚酞溶液滴入该“食用碱面”的溶液中,溶液变红,就可得出该“食用碱面”的主要成分是Na2CO3.这种说法对吗?并请说明原因:_____。
(拓展应用)已知Na2CO3与稀盐酸反应非常剧烈。实验室欲用Na2CO3固体和稀盐酸制取并收集二氧化碳,你选择的装置最好是_____(选填图2中装置序号)。