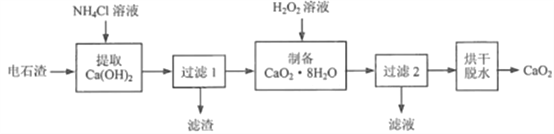
题目内容
【题目】熙熙有一只银手镯(银锌合金),他想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25. 00克再将50克稀盐酸分多次加入与此手镯充分反应,实验数据如下表:
加入稀盐酸的质量(克) | 充分反应后剩余固体的质量(克) | |
第1次 | 10.00 | 24.35 |
第2次 | 10.00 | 23.70 |
第3次 | 10.00 | 23.05 |
第4次 | 10.00 | 23.00 |
第5次 | 10.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是 克;
(2)所用稀盐酸中溶质的质量分数是多少?
(3)向第5次反应后的溶液中加入足量AgNO3溶液,能生成AgCl的质量是 克。
【答案】(1) 23.00 (2) 7.3%(3) 14.35
【解析】
(1)银手镯是银锌合金,即银锌的混合物,其中的锌能与稀盐酸反应,银不与稀盐酸反应,向银手镯中加入稀盐酸,银手镯减少的质量是参加反应的锌的质量,第5次加入稀盐酸后,银手镯的质量不再减少,说明银手镯中的锌已经反应完全,银的质量为23g。
(2)由表格可以看出,第一次加入10克稀盐酸,固体质量减少25g-24.35g=0.65g,第二次加入10克稀盐酸,固体质量减少24.35g-23.70g=0.65g,即10克稀盐酸可反应掉0.65g的锌。
设与0.65g锌恰好完全反应消耗的稀盐酸中氯化氢的质量为x。
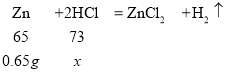
![]() ,解得x=0.73g
,解得x=0.73g
稀盐酸的溶质质量分数为: ![]() =7.3%
=7.3%
(3)第五次加入稀盐酸后所得溶液是氯化锌与盐酸的混合溶液,两种物质都能与硝酸银溶液反应生成氯化银沉淀,氯化银沉淀是混合溶液中的氯离子与硝酸银溶液中的银离子反应生成的。设生成氯化银沉淀的质量为y。

![]() ,解得x= 14.35g。
,解得x= 14.35g。

【题目】醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%~5%的醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是____________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为_____________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式________________。
(3)某同学对白醋的性质进行如下探究。
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入______ | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | __________________ | 白醋能与活泼金属反应 |
③将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是_________ |
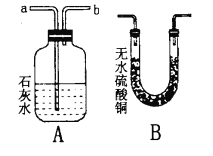
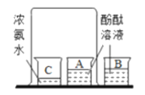
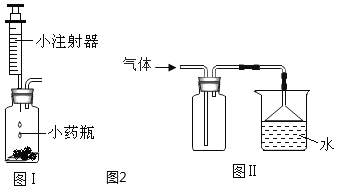
(4)若用如图装置验证水和二氧化碳两种气体生成物,应将生成的混合气体先通过_________装置,反之会有何影响?_______________。若将气体通入装置A进行验证时,气流应从_______________口通入。