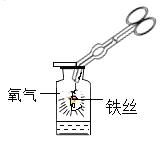
题目内容
【题目】某品牌的矿泉水,其外包装上部分文字说明如图所示,请回答下列问题。

(1)氯化钾中氯离子的符号是_____;
(2)硫酸镁的化学式是_____;
(3)标出偏硅酸(H2SiO3)中硅元素的化合价_____;
(4)25℃时,该矿泉水呈_____(填“酸性”、“中性”或“碱性”)。
【答案】Cl- MgSO4 ![]() 碱性
碱性
【解析】
(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。氯离子表示为Cl-.故填:Cl-;
(2)在化合物中,镁元素显+2价,硫酸根显-2价,所以硫酸镁的化学式为MgSO4;故填:MgSO4;
(3)在H2SiO3中,H元素的化合价为+1,O元素的化合价为-2,设Si元素的化合价为x,根据化合物中正负化合价的代数和为0,则
(+1)×2+x+(-2)×3=0,解得x=+4。
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以偏硅酸(H2SiO3)中硅元素的化合价为+4价表示为![]() ;故填:
;故填:![]() ;
;
(4)25℃时,该矿泉水的pH在7.2~7.5之间,pH>7,溶液显碱性;故填:碱性。

【题目】为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
氢氧化钠溶液质量/g | 40 | 40 | 40 | 40 | 40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
试分析计算。
(1)m的值为_____。
(2)固体混合物中硫酸镁的质量分数。_____(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。_____