题目内容
【题目】粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如下图所示:
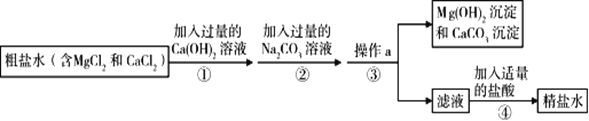
(1)Ca(OH)2俗称:____,其溶液的pH____7(选填“>”“<”或“=”)。①反应的化学方程式为_____。
(2)步骤②操作a的名称是___。步骤④加入适量盐酸的目的是除去滤液中的___和___(填化学式)。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有____。
(4)将精盐水制成食盐晶体的方法是___。
【答案】熟石灰或消石灰 > MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓ 过滤 NaOH Na2CO3 CaCl2 蒸发结晶
【解析】
(1)根据氢氧化钙的俗称、溶液的酸碱性以及化学方程式的写法来分析;
(2)经过①②后,要进行过滤实验除去沉淀;加入适量的盐酸可以除去滤液中多余的Na2CO3和NaOH;
(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2分析;
(4)根据氯化钠的溶解度受温度的影响来分析。
(1)氢氧化钙俗称熟石灰(或消石灰),是一种碱,其水溶液的pH>7;Ca(OH)2溶液只能与粗盐水中的MgCl2反应,化学反应方程式是:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;故答案为:熟石灰(或消石灰);>;MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓。
(2)经过①②后,生成沉淀,要进行过滤实验除去沉淀,所以步骤③操作a的名称是过滤;因为步骤①中过量的氢氧化钙和生成的氯化钙与步骤②中过量的碳酸钠反应,生成碳酸钙沉淀、氯化钠、氢氧化钠。所以步骤④加入适量的盐酸可以除去滤液中步骤②加入的多余的Na2CO3和生成的NaOH;故答案为:过滤;NaOH;Na2CO3;
(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2和过量的氢氧化钙。如果步骤①和步骤②的顺序颠倒,步骤②先反应溶液中就有过量的碳酸钠,然后完成步骤①,这时过量的氢氧化钙把上步中多余的碳酸钠除去,同时生成氢氧化钠,另外氢氧化钙与氯化镁反应还生成氯化钙,最后步骤④中加入适量的盐酸,反应掉生成的氢氧化钠,但不与生成的氯化钙反应,所以最后所得的精盐水中还含有CaCl2.故答案为:CaCl2;
(4)氯化钠的溶解度受温度影响比较小,故可采用蒸发结晶得到氯化钠晶体;故填:蒸发结晶。

【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | ______________ | ______________________________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是______________(填序号).

①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______________________________;她的改进措施是_______________________________________________________.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________,可以观察到的现象是________________________________________.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是____________(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为_______g.
③过滤、蒸发时都需用到的仪器是__________(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.
【题目】潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应原理是:2Na2O2+2CO2═2Na2CO3+O2,为验证该反应产物,某兴趣小组进行如下实验探究。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。
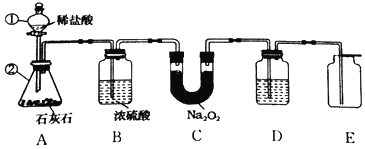
(1)装置A中标号仪器名称:①________,②________。
(2)装置A中反应的化学方程式为________。
(3)装置B的作用是________。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是________溶液。
(5)验证过氧化钠与二氧化碳反应产物
步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 将带火星的木条伸入装置E中 | _____ | 产物中有氧气 |
② | 反应后取装置C中少量固体于试管中,加水完全溶解 | _____ | 固体中有未反应的过氧化钠 |
③ | 向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 | _____ | 产物中有碳酸钠 |
【题目】某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为25.0g).
烧杯+盐酸 | 大理石 | 充分反应后烧杯+剩余物 | |
甲 | 75.0g | 13.2g | 83.8g |
乙 | 75.0g | 16.0g | 86.6g |
丙 | 95.0g | 13.2g | 103.8g |
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数(计算结果精确到0.1%).