题目内容
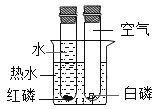
【题目】甲、乙、丙是初中化学中常见的物质,下图中“一”表示相连的物质之间能发生反应, “→”表示由一种物质转化为另一种物质。下列说法中不正确的是( )
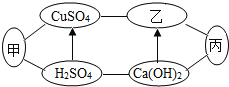
A.甲、乙、丙可能依次为Fe、NaOH、CO2
B.当乙为NaOH时,它可由Ca(OH)2与Na2CO3反应生成
C.当甲为一种碱时,它与硫酸铜溶液反应可能生成两种沉淀
D.丙物质只能是氧化物或盐
【答案】D
【解析】
A. 甲为铁,它可以与硫酸和硫酸铜分别反应;乙可以是氢氧化钠,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,氢氧化钙与碳酸钠反应可以生成碳酸钙和氢氧化钠;丙为二氧化碳,它可以与氢氧化钠和氢氧化钙反应生成碳酸钙与水。所以甲、乙、丙可能依次为Fe、NaOH、CO2。故A不符合题意;
B. 当乙为NaOH时,Ca(OH)2可与Na2CO3反应生成碳酸钙和氢氧化钠。故B不符合题意;
C. 当甲为氢氧化钡时,它与硫酸铜溶液反应可能生成硫酸钡和氢氧化铜两种沉淀。故C不符合题意;
D. 由以上分析可知,乙为氢氧化钠,丙物质可以与氢氧化钠和氢氧化钙反应,所以丙除了可以是二氧化碳或盐外,还可以是酸。故D符合题意。
故选D。

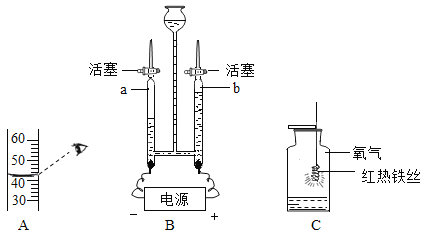
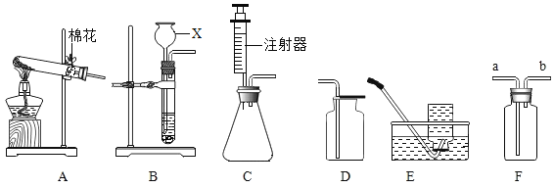
【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的是()
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
C | 探究空气是燃烧的必要条件 |
| D | 探究同种物质在不同溶剂中的溶解性 |
|
A.AB.BC.CD.D
【题目】小江同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如下定量实验(石灰石样品中的杂质不与盐酸反应).
实验步骤 | 将适量盐酸加入烧杯中并称重 | 称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | 待反应完全后,称重 |
实验数据 | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
试通过计算,分析该石灰石样品中碳酸钙的质量分数是否符合要求?_____