题目内容
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(2)将80℃时,同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_
(3)20℃时,向两只分别盛有35g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是
Ⅱ.阅读下列三段材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.

材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间.
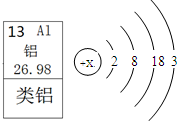
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如右图所示.
(1)镓元素的质子数为
(2)请根据上述材料,小结金属镓的有关知识:
①物理性质:镓是银白色金属,密度为5.94g?cm-3
②化学性质(请用化学方程式表示):
| ||
| ||
③用途:
Ⅱ.(1)根据在原子中,质子数=核外电子数,进行解答;离原子核最远的是最外层,依据原子结构示意图即可解答;(2)物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(2)降温后溶解度减小的多的析出的晶体多,由图表中数据可知析出晶体最多的是KCl;
(3)20℃时NaCl的溶解度是36g,KCl的溶解度是34g,所以20℃时,向两只分别盛有35g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是KCl,其溶液的溶质质量分数是:
| 34g |
| 134g |
(4)不饱和溶液变为饱和溶液的方法有:加入溶质、蒸发溶剂、降低温度,因为是温度不变的情况下变为饱和,所以可以加入溶质,恒温蒸发溶剂;
Ⅱ.(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;最外层电子数为:3易失去3个电子,显+3价,氯元素在最后显-1价,所以氯化物的化学式为:GaCl3;
(2)根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H2O
| ||
根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
故答案为:Ⅰ.(1)36.6;(2)KCl;(3)KCl;25.4%;(4)加入氯化钾(或恒温蒸发溶剂);Ⅱ.(1)31;GaCl3;(2)②2Ga+6H2O
| ||

 名校课堂系列答案
名校课堂系列答案Ⅰ.下表是NaCl和KCl的溶解度数据,请回答下列问题.
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(2)将80℃时,同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_______(填“NaCl”或“KCl”)溶液.
(3)20℃时,向两只分别盛有35g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是______,其溶液的溶质质量分数是______(精确到0.1%).
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是______
_______.(写一种)
Ⅱ.阅读下列三段材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g?cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如右图所示.
(1)镓元素的质子数为______,其氯化物的化学式为______.
(2)请根据上述材料,小结金属镓的有关知识:
①物理性质:镓是银白色金属,密度为5.94g?cm-3
②化学性质(请用化学方程式表示):______;
③用途:______.
下表是NaCl和KCl的溶解度数据,请回答下列问题。
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
(1)40℃时,氯化钠的溶解度是 g。
(2)将80℃时, 同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_ (填“NaCl”或“KCl”)溶液。
(3)20℃时,向两只分别盛有35 g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是 ,其溶液的溶质质量分数是______(精确到0.1%)。
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是_____
___________。(写一种)
 Ⅱ.(6分)阅读下列三段材料,回答问题:
Ⅱ.(6分)阅读下列三段材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为
5.94g·cm-3,从而验证了元素周期表的正确性。随后科学家根据元素
周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于
制造半导体材料。镓的原子结构示意图如右图所示。
(1)镓元素的质子数为__________,其氯化物的化学式为_____________。
(2)请根据上述材料,小结金属镓的有关知识:
① 物理性质:镓是银白色金属,密度为5.94g·c m-3
m-3
② 化学性质(请用化学方程式表示):_____________________________________;
③ 用途:____________________________________。
 (2013?白云区一模)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题.
(2013?白云区一模)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题.