题目内容
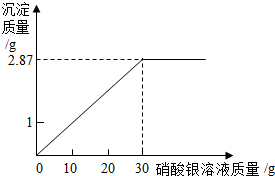 小强为测定某氯化钠溶液中溶质的质量分数,做了如下实验:向烧杯中加入10g该氯化钠溶液,然后向其中滴加硝酸银溶液,滴加硝酸银溶液的质量与产生沉淀的质量关系如图所示.已知:NaCl+AgNO3═NaNO3+AgCl↓.
小强为测定某氯化钠溶液中溶质的质量分数,做了如下实验:向烧杯中加入10g该氯化钠溶液,然后向其中滴加硝酸银溶液,滴加硝酸银溶液的质量与产生沉淀的质量关系如图所示.已知:NaCl+AgNO3═NaNO3+AgCl↓.请计算:
(1)AgNO3中氮、氧元素质量比为
(2)该氯化钠溶液中溶质的质量分数.
(3)滴加40g硝酸银溶液充分反应后溶液的质量.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据硝酸银的化学式即可解答;
(2)观察图象可知,沉淀的质量的最大值是2.87克,然后写出化学方程式并代入沉淀的质量计算出氯化钠的质量,最后计算出溶液中溶质的质量分数.
(3)根据质量守恒定律即可解答;
(2)观察图象可知,沉淀的质量的最大值是2.87克,然后写出化学方程式并代入沉淀的质量计算出氯化钠的质量,最后计算出溶液中溶质的质量分数.
(3)根据质量守恒定律即可解答;
解答:解:(1)AgNO3中氮、氧元素质量比为:14:16×3=7:24;故填:7:24;
(2)解:根据图象可知,当加入30克硝酸银溶液时,沉淀的质量达到最大值(2.87克),设需要氯化钠的质量是X.
NaCl+AgNO3═NaNO3+AgCl↓
58.5 143.5
x 2.87g
=
得:X=1.17
溶液中氯化钠的质量分数=
×100%═11.7%.
(3)滴加40g硝酸银溶液充分反应后溶液的质量是:10g+40g-2.87g=47.13g,
答:(2)溶液中氯化钠的质量分数为11.7%.
(3)滴加40g硝酸银溶液充分反应后溶液的质量是47.13g.
(2)解:根据图象可知,当加入30克硝酸银溶液时,沉淀的质量达到最大值(2.87克),设需要氯化钠的质量是X.
NaCl+AgNO3═NaNO3+AgCl↓
58.5 143.5
x 2.87g
| 58.5 |
| x |
| 143.5 |
| 2.87g |
得:X=1.17
溶液中氯化钠的质量分数=
| 1.17g |
| 10g |
(3)滴加40g硝酸银溶液充分反应后溶液的质量是:10g+40g-2.87g=47.13g,
答:(2)溶液中氯化钠的质量分数为11.7%.
(3)滴加40g硝酸银溶液充分反应后溶液的质量是47.13g.
点评:学会分析图象并从图象中得到信息的方法,一般观察图象的转折点;计算时注意计算格式和规范性.

练习册系列答案
相关题目
 如图是A、B、C三种固体物质的溶解度曲线.下列说法正确的是( )
如图是A、B、C三种固体物质的溶解度曲线.下列说法正确的是( )| A、t1℃时,A的饱和溶液中溶质质量分数为25% |
| B、t2℃时,A、B、C三种物质的溶解度大小关系为A=B>C |
| C、将t1℃时A、C的饱和溶液升温到t2℃时,A、C两溶液都会变成不饱和溶液 |
| D、B中含有少量A,要提纯B通常可采用冷却热饱和溶液的方法 |
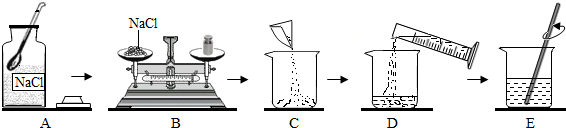
 盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动:
盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动: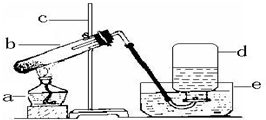 如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题:
如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题: 如图是某同学制作的简易净水器,请回答下列问题:
如图是某同学制作的简易净水器,请回答下列问题: