题目内容
【题目】把20.4g铜和铁的混合粉末放入烧杯中,先加入100g8%硫酸铜溶液,充分反应后,再加入300g9.8%的稀硫酸,完全反应,过滤、洗涤、干燥得9.6g固体。下列判断错误 的是
A.反应过程中共生成0.4gH2
B.反应中共消耗的硫酸溶液为200g
C.原混合物中Cu的质量为6.4g
D.最后得到的9.6g固体中一定含有铜,可能含有铁
【答案】D
【解析】
分析题目,已知铁与硫酸铜反应生成铜的质量大于参加反应铁的质量,如果混合粉末中的铁完全与硫酸铜反应,则得到的固体铜的质量应该大于20.4g,但得到的固体铜质量为9.6g小于20.4g,说明铁除了与硫酸铜溶液反应外,还有一部分铁与硫酸反应。
设参与硫酸铜溶液反应的铁的质量为X,生成铜的质量为Y。
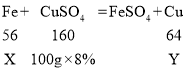
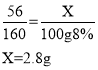
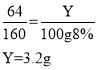
原固体混合物中铜的质量为![]() ,原固体混合物中铁的质量为
,原固体混合物中铁的质量为![]() ,与硫酸反应的铁的质量为
,与硫酸反应的铁的质量为![]() 。
。
设参加反应的硫酸的质量为M,生成氢气的质量为Z。
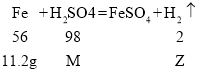
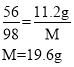
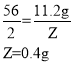
需要9.8%的稀硫酸的质量为![]() 。
。
A、反应过程中共生成0.4gH2,A正确;
B、反应中共消耗的硫酸溶液为200g,B正确;
C、原混合物中Cu的质量为6.4g,C正确;
D、最后得到的9.6g固体中一定含有铜,一定不含铁,因为反应共消耗硫酸溶液200g,还有硫酸溶液剩余,D不正确,故选D。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目