题目内容
【题目】下图表示几种常见物质在一定条件下可以转化。A 是石灰石的主要成分,E、G 为黑色的粉末,C 为常见的无色液体,H 为紫红色固体。(部分条件省略)
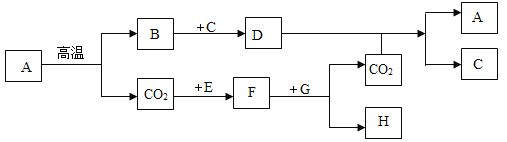
(1)D 可用于_____;
(2)F 和 G 反应是否属于置换反应_____(填“是”或“否”);
(3)CO2 和 D 溶液反应的化学方程式是:_____;
(4)CO2 和 E 反应生成 F 属于_____反应(填“吸热”或“放热”)。
【答案】改良酸性土壤(答案合理即可) 否 Ca(OH)2+CO2=CaCO3↓+H2O 吸热
【解析】
A是石灰石的主要成分,所以A是碳酸钙。A在高温的条件下会分解为氧化钙和二氧化碳,所以B是氧化钙。C为无色液体,且能和氧化钙反应生成D,因此C是水,D是氢氧化钙。氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水。
E、G为黑色粉末,E和二氧化碳反应生成F,F和G反应生成二氧化碳和H,H是紫红色固体,因此E是碳,F是一氧化碳。一氧化碳还原氧化铜,生成铜和二氧化碳,则G是氧化铜,H是铜。
(1)根据分析可知,D是氢氧化钙。氢氧化钙可以用于改良酸性土壤。故答案为:改良酸性土壤(答案合理即可);
(2)置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物。F是一氧化碳,G是氧化铜。一氧化碳还原氧化铜生成铜和二氧化碳。该反应不符合置换反应的定义。故答案为:否;
(3)D是氢氧化钙溶液。二氧化碳和氢氧化钙溶液反应生成碳酸钙沉淀和水。故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;
(4)二氧化碳和碳反应生成一氧化碳。该反应属于吸热反应。故答案为:吸热。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
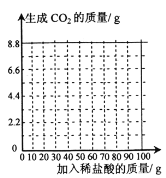
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】氢氧化钙久置会逐渐变质为碳酸钙。实验室有一瓶部分变质的氢氧化钙样品,为测定其中碳酸钙的质量分数,取16.2g样品于烧杯中,加足量的水,再将100g稀盐酸逐渐缓慢加入烧杯中并不断搅拌,获得相关数据如下表(提示:氢氧化钙先与盐酸反应时无气体产生),请回答问题并计算。
加入稀盐酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100 |
生成CO2的质量/g | 0 | 2.2 | 4.4 | m | 5.5 |
(1)氢氧化钙变质是它与空气中的____________发生了反应。
(2)表中m的数值为_____________。
(3)试计算样品中碳酸钙的质量分数___________(请在答题卡上写出计算过程,计算结果精确到0.1%)。
(4)请在坐标中画出加入稀盐酸的质量与生成CO2的质量之间的变化关系图___________。