题目内容
【题目】甲、乙两种物质的溶解度曲线如图. 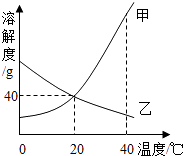
(1)20℃时,甲物质的溶解度为g;
(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是;
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量(选填“>”或“=”或“<”)乙物质溶液的质量.
(4)下表为KCl在不同温度下的溶解度:
温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
①由上表可推测KCl溶解度随温度的升高而(填“增大”或“减小”).
②在10℃时,向100g水中加入40g KCl固体,充分混合溶解后所得溶液为(填“饱和”或“不饱和”)溶液,此过程中的玻璃棒的作用为;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为(计算结果精确到0.1%).
【答案】
(1)40
(2)加水或降温
(3)<
(4)增大;饱和;加快溶解速率;28.6%
【解析】解:(1)20℃时,甲物质的溶解度为40g;(2)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是加水或降温;(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,由甲物质析出,故所得甲物质溶液的质量<乙物质溶液的质量.(4)由表中KCl在不同温度下的溶解度可知:
温度╱℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度╱g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
①由上表可推测KCl溶解度随温度的升高而增大.②在10℃时,因为其溶解度为31.0克,故可知向100g水中加入40gKCl固体,充分混合溶解后所得溶液为饱和溶液;此过程中的玻璃棒的作用为加快溶解速率;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为 ![]() ×100%=28.6%.
×100%=28.6%.
故答为:(1)40; (2)加水或降温;(3)<;(4)①增大 ②饱和 加快溶解速率 28.6%
【考点精析】解答此题的关键在于理解饱和溶液和不饱和溶液相互转变的方法的相关知识,掌握饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂,以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 阅读快车系列答案
阅读快车系列答案【题目】麻婆豆腐在清朝末年便被列为成都经典名菜.其配料见下表,此菜富含动植物蛋白质、钙、磷、铁、维生素及碳水化合物.具有温中益气、解毒润燥等功效.
原料:嫩豆腐、牛肉、青蒜苗 |
(1)原料中提供蛋白质较多的是等(填一种即可).
(2)此处钙、磷、铁主要指(填“单质”“化合物”或“元素”),其中磷、铁的元素符号是、 .
(3)将生石膏(CaSO42H2O)放进火中烙烧是制作石膏豆腐的一个关键工序.生石膏加热至163℃,失去结晶水变成熟石膏(CaSO4).该反应的化学方程式是 .