题目内容
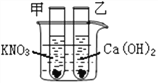
【题目】做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)某同学处理废液时做了如下实验:取废液缸中上层清液 40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
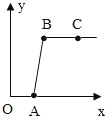
A.图中纵坐标(y)表示生成 CO2 的质量
B.反应进行到B点时,溶液中的溶质是 NaCl
C.OA段发生反应的化学方程式是 Na2CO3+CaCl2=2NaCl+CaCO3↓
D.C点溶液的 pH=7
【答案】B
【解析】
盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,碳酸钠和氯化钙反应生成碳酸钙和氯化钠。
A、碳酸钠与稀盐酸和氯化钙的混合溶液的反应原理,向混合溶液中逐滴滴入 Na2CO3溶液至过量,刚开始是稀盐酸的量多,而碳酸钠的量少,溶液中应先冒气泡,而不是先产生沉淀,图中纵坐标(y) 应该表示生成的沉淀质量,故A不正确;
B、当反应进行到 B 点时,表明反应完全结束,此时溶液中的溶质只有NaCl,故B正确;
C、从 开 始 反 应 的 O 点 到 A 点 的 OA 段 , 发 生 了 的 化 学 反 应 的化学方程式为 Na2CO3+2HCl=2NaCl+H2O+CO2↑,此时没有沉淀产生,等溶液中稀盐酸被消耗完了以后,才慢慢开始产生沉淀,Na2CO3+CaCl2 =CaCO3↓+2NaCl,故C不正确;
D、实验探究进行到C点时,反应早已经结束,过量的碳酸钠溶液加入其中,溶液的pH大于7,故D不正确。故选B。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目