题目内容
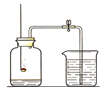
【题目】如图所示,打开分液漏斗,使其中的无色液体(足量)与试管中的固体(足量)接触反应,可观察到有气球明显胀大的现象,请写出两个符合图中现象的化学方程式.
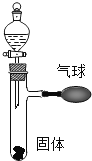
(1)______;
(2)______.
【答案】2H2O2![]() O2↑+2H2O CaO+H2O=Ca(OH)2
O2↑+2H2O CaO+H2O=Ca(OH)2
【解析】
根据题意可知固体和液体在不加热的条件下反应有气体生成的都符合,例如过氧化氢在二氧化锰的催化下生成氧气,碳酸钙和稀盐酸反应生成二氧化碳,活泼金属和酸的反应,还可以利用反应放热,是试管内空气膨胀,如氧化钙和水的反应,等等,只要合理即可,
(1)过氧化氢在二氧化锰的催化作用下能分解生成氧气而使装置内的压强增大从而使气球变大,故填2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)氧化钙与水反应放出大量的热而使装置内的温度升高,从而压强增大而使气球胀大,故填CaO+H2O=Ca(OH)2。

 口算题天天练系列答案
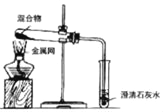
口算题天天练系列答案【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物 1~2.5g进行系列实验。
(查阅资料)①碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;
②氧化亚铜为红色固体,能与稀硫酸反应:
Cu2O+H2SO4=CuSO4+H2O+Cu。
(进行实验)
实验 1:取质量比 1:11 的木炭粉和氧化铜混合物 1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反 应 后 物 质 的颜色、状态 | 黑色粉末中混有少量红色固体。 | 红色固体有金属光泽,混有 极少量黑色物质。 |
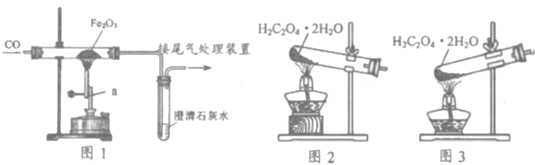
实验 2:取一定量的混合物,用 1﹣2 装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)实验中酒精灯火焰处罩金属网的作用:_____;
(2)加热试管中的固体,一般试管口要向_____倾斜,但在实验 1﹣2 中试管却可以 垂直向上放置,这是因为_____;
(3)实验 1﹣2 中,证明产生了 CO2 的现象是_____;
(4)实验 2 的结论是_____;
(反思与评价)
(5)实验 2 没有进行质量比为 1:14 的实验,理由是_____;
(6)为检验 2﹣4 的红色固体中是否含 Cu2O,所需试剂是_____。
(7)实验改进的思路和方法很多,本题是从_____的设计和_____的控制两个方面的改进来达到实验效果的最优化。