题目内容
【题目】依据下列溶解度曲线和实验过程回答下列小题
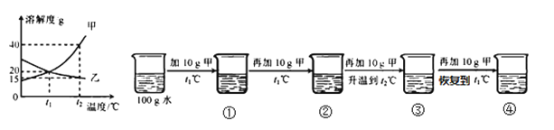
【1】①~④所得溶液属于饱和溶液的是
A. ①③B. ②④C. ②③D. ③④
【2】下列关于①~④所得溶液的说法不正确的是
A. 溶质质量:③<④B. 溶液质量最大的是③
C. 溶质质量分数:②=④D. ④中溶质与溶剂的质量比为1:5
【答案】
【1】B
【2】A
【解析】
【1】由曲线图可知,①时温度为t1℃,溶质为10g,是不饱和溶液;②时温度为t1℃,溶质为20g,刚好饱和;③时温度为t2℃,溶质为30g,是不饱和溶液;④时温度为t1℃,物质甲为40g,是饱和溶液。故②④正确,选B。
【2】A、溶质质量:③时溶质质量为30g;④时温度为t1℃,溶质质量为20g,故溶质质量:③>④,选项A不正确;
B、溶质质量:①为10g,②为20g,③为30g,④为20g,溶剂均为100g水,故溶液质量最大的是③,选项B正确;
C、溶质质量分数:②④的溶质均为20g,溶剂均为100g水,故溶质质量分数相等,选项C正确;
D、④的溶质为20g,溶剂为100g水,则其质量比为1:5,选项D正确。
故选A。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫各小组开展探究。
(提出问题)这瓶无色溶液究竟是什么物质的溶液?
(猜想与假设)经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里。由此猜测:可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
(理论分析)为了确定该溶液,他们首先进行了
(1)甲同学根据标签上的组成元素认为一定不可能是______溶液。
(2)乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是______。
(设计实验)为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验。
实 验 操 作 | 实 验 现 象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液。 ②静置后,倾去上层清液,向沉淀中滴加稀盐酸。 | 产生白色沉淀。产生大量气泡,沉淀消失。 |
(实验结论)
(3)该瓶无色溶液的溶质是_____。生成白色沉淀的化学方程式是______。
(实验反思)
(4)丙同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实 验 操 作 | 实 验 现 象 | 实验结论 |
______ | ______ | ______ |
【题目】图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 上述图象表示碳酸钠的溶解度曲线
B. 20℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D. 40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象