题目内容
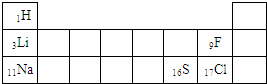
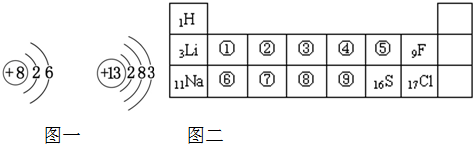
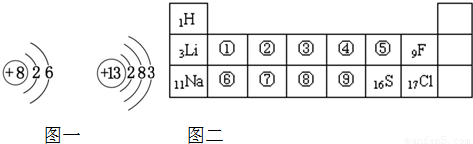
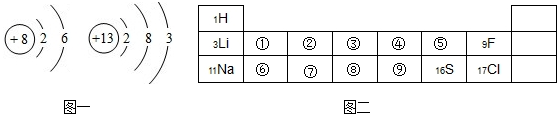
图一表示氧、铝两种元素的原子结构示意图,图二是元素周期表的一部分
(1)氧元素和铝元素在表中的位置分别是
(2)上表中氧元素的一个原子需要得到

(1)氧元素和铝元素在表中的位置分别是
⑤
⑤
和⑦
⑦
(填序号);(2)上表中氧元素的一个原子需要得到
2
2
个电子形成相对稳定结构的离子,该离子符号表示为O2-
O2-
.分析:(1)根据原子结构可知在周期表中的周期和族,确定元素在周期表中的位置;
(2)根据原子结构中最外层电子数来分子得电子的情况及形成的离子.
(2)根据原子结构中最外层电子数来分子得电子的情况及形成的离子.
解答:解:(1)因氧原子的结构有2个电子层,最外层电子数为6,则在周期表中第二周期VIA族,即在⑤处,
由铝原子的结构可知有3个电子层,最外层电子数为3,则在周期表中第三周期IIIA族,即在⑦处,
故答案为:⑤;⑦;
(2)由氧原子的结构示意图可知,其最外层电子数为6,则容易得到2个电子而满足最外层8电子的稳定结构,
则氧离子带2个单位的负电荷,其符号为O2-,故答案为:2;O2-.
由铝原子的结构可知有3个电子层,最外层电子数为3,则在周期表中第三周期IIIA族,即在⑦处,
故答案为:⑤;⑦;
(2)由氧原子的结构示意图可知,其最外层电子数为6,则容易得到2个电子而满足最外层8电子的稳定结构,
则氧离子带2个单位的负电荷,其符号为O2-,故答案为:2;O2-.
点评:本题考查原子结构与元素周期表的关系,学生应学会利用原子结构来分析元素在周期表的位置,并能利用最外层电子数来分析形成的离子来解答.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目