题目内容
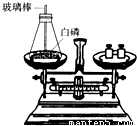
(1)如图所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验.①白磷在锥形瓶中燃烧时,常常导致瓶塞被冲开,实验失败.导致瓶塞被冲开的原因是什么?
②为了防止瓶塞被冲开,你能将实验作如何的改进?
③实验时,用加热后的玻璃棒点燃白磷,你还能找出其他方法点燃瓶内的白磷吗?
(2)已知工业上用电解氧化铝的方法制取单质铝的化学方程式为:2Al2O3
 4Al+3O2↑对于解答:“电解10t氧化铝最多可生产多少吨铝?”一题,
4Al+3O2↑对于解答:“电解10t氧化铝最多可生产多少吨铝?”一题,小倩和小明两位同学分别采用下面两种不同解法:
| 小倩同学的解法 | 小明同学的解法 |
| 解:设生成的铝质量为X 2Al2O3 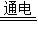 4Al+3O2↑ 4Al+3O2↑204108 10t X 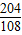 = =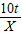 X=5.3t 答:最多可生产5.3t铝 | 解:氧化铝中铝元素的质量分数为 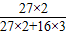 ×100%=53% ×100%=53%铝的质量为10t×53%=5.3t 答:最多可生产5.3t铝 |
①你认为他们的解题思路和方法都正确吗?并说明理由.
②对“34g过氧化氢完全分解产生氧气质量为多少克?”一题,你认为也能用上述两种方法解答吗?并说明理由.
③请你把②的正确解法写出来.
【答案】分析:(1)①根据白磷燃烧结合装置的特点分析;
②为了防止瓶塞被冲开,应减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③因白磷着火点低,可用酒精灯给锥形瓶底部微热来点燃白磷;
(2)①小倩用的是“根据化学方程式的计算”,小明用的是根据元素的质量分数的计算,他们的解题思路和方法都正确;但小明的解题方法有局限性,只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用;
②本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在H2O中存在;
③由①和②的解题过程可知,小倩同学的解法在任何情况下都能使用;而只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用小明同学的解法.
解答:(1)①白磷燃烧放出大量的热,使瓶内气体体积迅速膨胀,瓶内压强大于外部压强,常常导致瓶塞被冲开,实验失败;
②为了防止瓶塞被冲开,应减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③因白磷着火点低,可用酒精灯给锥形瓶底部微热来点燃白磷;
故答案为:①白磷燃烧放出大量的热,使瓶内气体体积迅速膨胀,瓶内压强大于外部压强,常常导致瓶塞被冲开,实验失败;
②减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③可用酒精灯给锥形瓶底部微热来点燃白磷;
(2)①都正确,因为在电解过程中,氧化铝中的铝全部变成单质铝;
故答案为:都正确;因为在电解过程中,氧化铝中的铝全部变成单质铝;
②不能,因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气,故只能用小倩的方法来解.
故答案为:不能;因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气;
③解:设产生氧气的质量为X,
2H2O2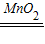 2H2O+O2↑
2H2O+O2↑
2×34 32
34g X
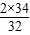 =
=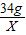
X=16g
答:产生氧气的质量为16g.
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
②为了防止瓶塞被冲开,应减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③因白磷着火点低,可用酒精灯给锥形瓶底部微热来点燃白磷;
(2)①小倩用的是“根据化学方程式的计算”,小明用的是根据元素的质量分数的计算,他们的解题思路和方法都正确;但小明的解题方法有局限性,只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用;
②本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在H2O中存在;
③由①和②的解题过程可知,小倩同学的解法在任何情况下都能使用;而只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用小明同学的解法.
解答:(1)①白磷燃烧放出大量的热,使瓶内气体体积迅速膨胀,瓶内压强大于外部压强,常常导致瓶塞被冲开,实验失败;
②为了防止瓶塞被冲开,应减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③因白磷着火点低,可用酒精灯给锥形瓶底部微热来点燃白磷;
故答案为:①白磷燃烧放出大量的热,使瓶内气体体积迅速膨胀,瓶内压强大于外部压强,常常导致瓶塞被冲开,实验失败;
②减小白磷的量或把锥形瓶放在盛有冷水的烧杯中;
③可用酒精灯给锥形瓶底部微热来点燃白磷;
(2)①都正确,因为在电解过程中,氧化铝中的铝全部变成单质铝;
故答案为:都正确;因为在电解过程中,氧化铝中的铝全部变成单质铝;
②不能,因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气,故只能用小倩的方法来解.
故答案为:不能;因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气;
③解:设产生氧气的质量为X,
2H2O2
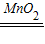 2H2O+O2↑
2H2O+O2↑ 2×34 32
34g X
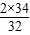 =
=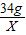
X=16g
答:产生氧气的质量为16g.
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
 某校同学对市场上的食品疏松剂进行了如下探究.
某校同学对市场上的食品疏松剂进行了如下探究.实验一:甲小组的同学收集到一包主要成分是小苏打(碳酸氢钠)的疏松剂
(1)取样品溶于适量的水中,测得溶液的pH大于7.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为
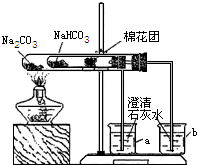
(3)同学们通过查阅资料,在老师的指导下采用了如图所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水了现白色浑浊.试回答:①在实验结束时,操作上要注意的问题是:
②由实验(3)可以得出的结论是
实验二:乙小组的同学收集到一包名为“臭粉”的疏松剂,为探究其组成,进行实验:
(1)“臭粉”为一种白色固体,易溶于水;
(2)取少量样品与稀盐酸混合后产生了可以使石灰水变混浊的气体;
(3)取少量样品加热后,产生了有刺激性气味的气体;
(4)少量样品与氢氧化钠溶液混合后共热,产生了使湿润的红色石蕊试纸变蓝的臭气.
调查后得知,“臭粉”的主要成分是初中化学课本中一种常见的盐.
①你认为该盐是
②用“臭粉”作疏松剂的油炸食品放置后再销售和食用的原因可能是
③某些小商贩喜欢选用“臭粉”代替“小苏打”作疏松剂的原因可能是
实验三:丙小组同学探究小苏打、“臭粉”在制作食品过程中产生气泡的原因
(1)两种疏松剂产生的气体中都含有
(2)小组的同学将少许面粉加入水中取上层液体用pH试纸测得:pH=7.猜测产生气体的原因是
实验四:丁小组的同学在某超市发现一种复合疏松剂--发酵粉,其成分见表:
| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
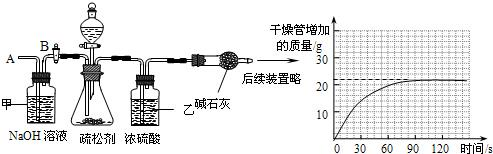
(2)为测定其中碳酸氢钠的质量分数,小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将50.0g试样放入锥形瓶中,加入足量某酸溶液;
Ⅱ.测量一定时间内干燥管内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量干燥管内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至干燥管内物质质量不变.
讨论:
①步骤Ⅰ.加入样品前还应检查
②装置乙的作用是
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程,本小题4分)