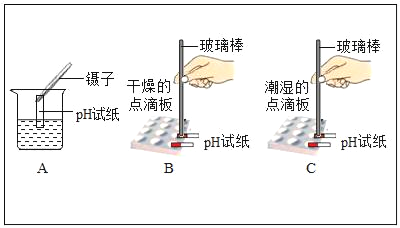
题目内容
【题目】如图为KNO3和NaCl两种物质的溶解度曲线.
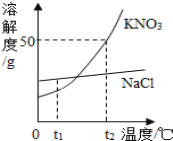
(1)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl_____溶液(填“不饱和”或“饱和”或“不能确定”).
(2)将t2℃时饱和的KNO3溶液100g恒温蒸发10g水,可析出KNO3的质量为_____g,剩下的溶液中的质量分数为_____.(结果保留小数点后1位)
(3)现有t2℃时KNO3溶液中含少量NaCl,若要得到较纯净的KNO3晶体,应采取的物理方法是_____.
(4)你从图中还可获得什么信息(写出一条即可):_____.
【答案】饱和 5 33.3% 降温结晶 氯化钠溶解度受温度影响不大(合理即可)
【解析】
(1)t2℃时,氯化钠的溶解度小于50g,故将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl饱和溶液;
(2)t2℃时硝酸钾的溶解度是50g,即100g水中最多溶解50g的硝酸钾,所以10g水最多溶解5g,故将t2℃时饱和的KNO3溶液100g恒温蒸发10g水,可析出KNO3为5g;剩下的溶液中的质量分数与原溶液相同为:![]() ;
;
(3)观察图示可知:氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大,所以要从KNO3溶液中含少量NaCl,若要得到较纯净的KNO3晶体,应采取的物理方法是,应采取降温结晶的方法;
(4)从溶解度曲线中可以看出:t2℃时硝酸钾的溶解度大于氯化钠的溶解度,氯化钠的溶解度受温度影响不大,硝酸钾的溶解度随温度升高而增大,且变化较大等。

 名校课堂系列答案
名校课堂系列答案【题目】H2O2生成O2的快慢与催化剂种类是否有关,以下是他们探究的主要过程:
(假设)H2O2生成O2的快慢与催化剂种类有关
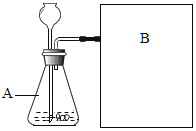
(实验方案)常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入二氧化锰和水泥块,生成一瓶25mL氧气
(进行实验)如图是他们进行实验的装置图,气体发生装置中A仪器名称是______,此实验中B处宜采用的气体收集方法是______。
(实验记录)
实验 | 过氧化氢溶液 | 气体物质 | 待测数据 |
1 | 5%20g | 无其它物质 | ______ |
2 | 5%20g | 水泥块0.5g | ______ |
3 | 5%20g | 二氧化锰 ______ g | ______ |
待测数据是______;二氧化锰______g。
(结论)该探究过程得出的结论是______。
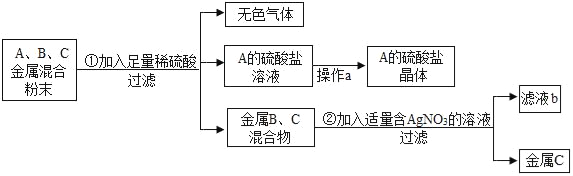
【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色的粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含![]() ;
;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则变质反应的化学方程式为_____。
(查阅资料)①碱性的Na2CO3溶液可以与中型的CaCl2溶液发生复分解反应;
②![]() 在饱和的碳酸氢钠溶液中几乎不溶解。
在饱和的碳酸氢钠溶液中几乎不溶解。
(实验探究1)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入 ____ | 白色沉淀产生 | 该反应的化学方程式:___ |
(2)将上述反应后的混合液过滤,取滤液加入____ | ______ | 证明猜想Ⅱ成立 |
(提出问题2)如何测量该部分变质样品中碳酸钠的质量分数?
(实验探究2)小红同学设计如图装置(铁架台略去),实验在27℃,101KPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL。请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 _________ ;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是 ________ ;
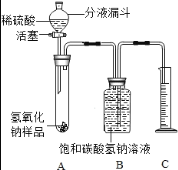
(3)试管中原有的空气对实验结果是否有明显影响? ___ (填“有”或“没有”);
(4)变质氢氧化钠样品中碳酸钠的质量分数为 __________。(在27℃,101KPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
(提出问题3)怎样提纯该样品得到纯净的氢氧化钠固体?
(实验探究3)为得到纯净的氢氧化钠固体,小亮设计了如图的实验流程。
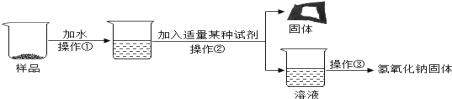
请回答下列问题:
(1)为了使样品充分溶解,操作①中还要用到的玻璃仪器是_________ ;操作③中加热到____________时停止加热。
(2)该实验中发生反应的化学方程式为 ____________ ;
(3)最终所得氢氧化钠固体质量 ________ 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
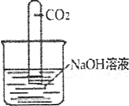
【题目】实验室用石灰水而不用氢氧化钠溶液鉴定二氧化碳。氢氧化钠能否与二氧化碳反应?
【查阅资料】Ⅰ.氢氧化钠溶液与二氧化碳反应生成易溶的碳酸钠,碳酸钠在二氧化碳过量的条件下继续与水和二氧化碳反应生成碳酸氢钠
Ⅱ.碳酸钠和碳酸氢钠性质对比如下表
操作 | NaHCO3溶液 | Na2CO3溶液 |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入稀CaCl2溶液 | 无明显变化 | __________________(填写现象)) |
加热溶液至沸腾,并将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
【进行实验】
实验操作 | 实验现象 | 结论及化学方程式 |
| ___________________ | 氢氧化钠与二氧化碳反应生成碳酸钠.反应方程式_______________ |
【实验反思】学习小组讨论,认为产生此实验现象的原因可能有两种:一种是NaOH与C02发生了反应;另一种是_______________
(2)为了进一步验证CO2与NaOH溶液已经发生反应,请你设计一个简单的实验检验生成的新物质。
实验步骤 | 实验现象 | 解释与结论 |
____________________________ | ____________________________ | NaOH与CO2发生了反应 |
【实验拓展】该小组同学将二氧化碳通入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,待完全反应后,观察到溶液中逸出大量气泡,pH出现两段S型变化曲线。

【实验分析】
(3)AB段变化的原因可能是________。BC段变化的原因可能是___________。利用实验验证变化后的产物,实验操作为_________________.实验现象是____________________。