题目内容
【题目】中和反应会放热,现用滴管吸取末知浓度的盐酸溶液,逐滴加入盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,同时用pH计记录溶液pH的变化,绘制成如下函数图像。
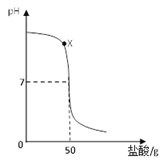
(1)用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有___________。(填化学式)
(2)验证“中和反应会放热”不能使用氢氧化钠固体和稀盐酸反应,是因为___________。
(3)试根函数图像据,求盐酸溶液中溶质的质量分数。(写出计算过程)
__________________________
【答案】 NaCl、NaOH NaOH固体溶于水也会放热,无法证明是中和放热 14.6%
【解析】(1)当溶液处于X点时,PH大于7,说明氢氧化钠过量,所以此时溶液中的溶质是NaCl 和NaOH,所以用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有:NaCl和NaOH;
(2)因为氢氧化钠固体溶于水时也会产生热量,这样就无法说明热量来自于中和反应了,所以不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”;
(3)从图中可知,当pH=7时,表示反应恰好完全,根据反应:NaOH+HCl==NaCl+H2O中NaOH与HCl的质量关系,可求出溶质HCl的质量。
解:设溶质NaCl的质量为x。
NaOH + HCl == NaCl + H2O
4036.5
40g×20% x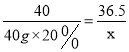
x=7.3g
∴溶液中溶质的质量分数= ![]() ×100%=14.6%。
×100%=14.6%。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】下表所列各组物质中,物质之间按箭头方向通过一步反应不能全部实现如图所示转化的是
物质 选项 | 甲 | 乙 |
|
A. | Fe2O3 | CO2 | H2O |
B. | C | CO | CO2 |
C. | CaCO3 | CaO | Ca(OH) 2 |
D. | H2SO4 | H2O | H2 |
A. A B. B C. C D. D
【题目】下列归纳和总结完全正确的一组是
A.化学反应基本类型 | B.化学反应中常见的“三” |
①化合反应:4P+5O2 ②分解反应:H2CO3═H2O+CO2↑ ③复分解反应:CO2+2NaOH=Na2CO3+H2O | ①煤、石油、天然气﹣三大化石燃料 ②塑料、合成纤维、合成橡胶﹣三大合成材料 ③分子、原子、离子﹣构成物质的三种粒子 |
C.对鉴别方法的认识 | D.化学与生活 |
①区分氮气和氧气﹣伸入带火星的木条 ②区分硬水和软水﹣加肥皂水 ③区分硫酸铵和氯化铵﹣加熟石灰粉末研磨 | ①用氢氧化钠改良酸性土壤 ②缺乏维生素C易患坏血病 ③缺乏碘元素易患甲状腺肿大 |
A. A B. B C. C D. D