题目内容
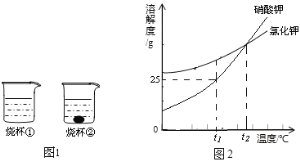
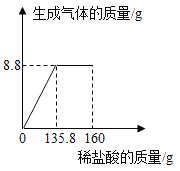
【题目】如图是A、B两种物质在不同温度下溶解于水形成饱和溶液的溶质质量分数的曲线,下列说正确的是
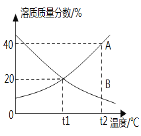
A. A中混有少量B可用降温结晶的方法提纯A
B. t1℃时,A、B溶液的溶质质量分数一定是20%
C. t2℃时,A的溶解度大于B,且A的溶解度为40g
D. t1℃时,等质量的A、B两种溶液中所含的溶质质量一定相等
【答案】AC
【解析】
A、A物质的溶质质量分数随温度的升高而增大,所以溶解度也随温度的升高而增大,B物质的溶质质量分数随温度的升高而减小,所以溶解度随温度的升高而减小,所以A中混有少量B可用降温结晶的方法提纯A,故A正确;
B、t1℃时,A、B两种物质的溶解度相同,饱和溶液溶质质量分数相同,但选项没有指明为饱和溶液,故B错误;
C、通过分析溶解度曲线可知,t2℃下A的溶解度一定大于B,且A的溶解度为40克,故C正确;
D、t1℃下,A、B物质的溶解度相等,溶液的状态不能确定,所以等质量的A、B两种溶液中所含的溶质质量不一定相等,故D错误;
故选:AC。

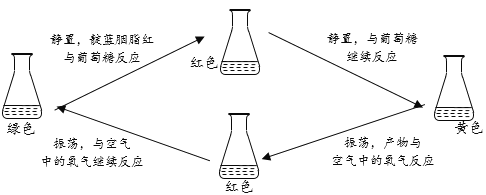
【题目】某小组对“化学红绿灯”实验感兴趣,进行以下实验,探究温度和靛蓝胭脂红溶液浓度对变色所需时间的影响。
(查阅资料)靛蓝胭脂红是一种指示剂;向靛蓝胭脂红和氢氧化钠的混合液(绿色)中,加入葡萄糖,静置时靛蓝胭脂红与葡萄糖逐步反应,而产物在振荡时又能与空气中的氧气反应,再逐步转化成靛蓝胭脂红。颜色变化可循环多次,过程如下:
(进行实验)
在锥形瓶中分别加入表中试剂,充分混合后,溶液为绿色。静置,观察并记录。
实验序号 | 0.1%靛蓝胭脂红溶液体积 / mL | 2%氢氧化钠溶液体积/ mL | 18%葡萄糖溶液体积 / mL | 水体积 / mL | 温度/℃ | 变色时间/s | |||
绿→红 | 红→黄 | 合计 | |||||||
① | 10 | 70 | 10 | 10 | 20 | 178 | 81 | 259 | |
② | 10 | 70 | 10 | 10 | 40 | 22 | 21 | 43 | |
③ | 10 | 70 | 10 | 10 | 60 | 6 | 5 | 11 | |
④ | 20 | 70 | 10 | 0 | 40 | 21 | 27 | 48 | |
⑤ | 5 | 70 | 10 | x | 40 | 25 | 5 | 30 | |
注:所用溶液的密度均按1 g/mL计。
(解释与结论)
(1)靛蓝胭脂红的化学式为C16H8N2Na2O8S2,碳元素与氢元素的质量比是______。
(2)实验⑤中,x =______mL。
(3)实验①②③的结论是______。
(4)能证明靛蓝胭脂红溶液浓度对变色所需时间有影响的实验是______(填序号)。
(反思与评价)
(5)上述实验循环多次后,当葡萄糖完全反应后,再经充分振荡、静置后,溶液颜色最终为______。
(6)除上述实验探究的因素外,还可能有的影响因素是______(写出一条即可)。