题目内容
【题目】胃酸的主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为6.5g-7.3g。某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用下图所示抑酸剂,发生反应:Mg(OH)2+2HCl=MgCl2+2H2O。请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是___克?理论上能否使该患者胃液恢复到正常范围?____
xxx牌复方抑酸剂
有效成分:氢氧化镁
作用用途:用于治疗胃酸过重
用法用童:口服,每次2片,每天3次
药物含量:每片含0.145g氢氧化镁
【答案】1.095 不能
【解析】
解:设每天最多可中和胃液中盐酸溶质质量x。
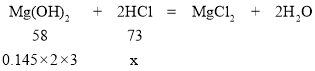
![]() 解之得:x=1.095g
解之得:x=1.095g
每天最多可中和胃液中盐酸溶质质量1.095g;
9.0g-1.095g=7.905g,正常人胃液每日需要盐酸溶质质量约为6.5g-7.3g,7.095g>7.3g,不能使该患者胃液恢复到正常范围。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
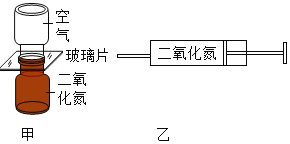
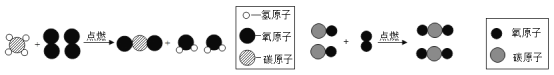
【题目】根据下图所示实验分析得出的结论中,不正确的是( )
|
|
|
|
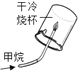
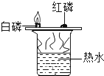
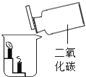
A.甲烷燃烧生成二氧化碳和水 | B.铁能在氧气中燃烧 | C.白磷的着火点比红磷的低 | D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
A. A B. B C. C D. D