题目内容
【题目】如图是实验室中常见的气体制备、净化、收集和性质实验的部分仪器。
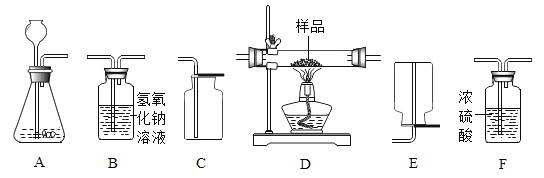
试根据题目要求,回答下列问题:
(1)在实验室中,用金属锌和稀盐酸制备氢气时,常会混有少量HCl。若收集一瓶干燥且不含HCl的氢气:
①所选装置的连接顺序为_____。
②制取气体前,需要先检查装置的_____。
③装置A中发生反应的化学方程式为_____。
④若用装置A制取CO2时,锥形瓶中应盛放的药品是_____。检验二氧化碳是否收集满的方法是_____。
(2)在实验室中,若以双氧水为原料(MnO2作催化剂)制备干燥的氧气,并用得到的氧气来测定10g由铜粉和炭粉组成的混合物样品中单质铜的含量,装置的连接顺序为:A→F→D→B(假设有关反应均恰好反应完全)。
①装置F的作用是_____。
②装置A中生成氧气的化学方程式为_____。
③D装置通入足量氧气,发生反应的类型是_____反应。充分反应后,室温下,称量玻璃管内剩余固体总质量变为8g,则原混合物样品中铜的质量分数是_____。
④实验结束后,要分离出装置A中锥形瓶内的固体,应采用的分离方法_____。
【答案】ABFE 气密性 ![]() 大理石或石灰石 将燃着的木条放在集气瓶口,如果木条熄灭,证明已收集满 干燥氧气(除去氧气中的水蒸气) 2H2O2
大理石或石灰石 将燃着的木条放在集气瓶口,如果木条熄灭,证明已收集满 干燥氧气(除去氧气中的水蒸气) 2H2O2![]() 2H2O+O2↑ 化合反应 64% 过滤
2H2O+O2↑ 化合反应 64% 过滤
【解析】
(1)在实验室中,用金属锌和稀盐酸制备氢气时,常会混有少量HCl。若收集一瓶干燥且不含HCl的氢气:
①所选装置的连接顺序为:A(固液发生装置)、B(氢氧化钠吸收氯化氢气体)F(浓硫酸干燥气体)E(氢气密度小于空气,用向上排空气法收集氢气);
②制取气体前,需要先检查装置的气密性,确保实验成功;
③装置A中锌和稀盐酸反应产生氯化锌和氢气的化学方程式为:![]() ;
;
④若用装置A制取CO2时,锥形瓶中应盛放的固体药品是大理石(或石灰石)。二氧化碳气体没有助燃性,检验二氧化碳是否收集满的方法是:将燃着的木条放在集气瓶口,如果木条熄灭,证明已收集满;
(2)在实验室中,若以双氧水为原料(MnO2作催化剂)制备干燥的氧气,并用得到的氧气来测定10g由铜粉和炭粉组成的混合物样品中单质铜的含量,装置的连接顺序为:A→F→D→B。
①装置F中的浓硫酸有西水洗,作用是:除去氧气中的水蒸气(干燥气体);
②装置A中双氧水在二氧化锰催化作用下产生水和氧气的化学方程式为: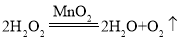
③D装置通入足量氧气,碳在氧气中燃烧产生二氧化碳,铜在加热条件下与氧气反应产生氧化铜,都符合“多变一”,都属于化合反应。充分反应后,室温下,称量玻璃管内剩余固体为氧化铜,质量变为8g,则铜元素的质量为=8g![]() ,则原混合物样品中铜的质量分数=
,则原混合物样品中铜的质量分数=![]() 。
。
④实验结束后,要分离出装置A中锥形瓶内的固体和液体,应采用的分离方法:过滤。

【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A. 实验①所得溶液质量分数为10%
B. 实验说明25℃时该物质的溶解度是20g
C. 实验③④所得溶液质量分数相同
D. 实验④所得溶液中含溶质20g