题目内容
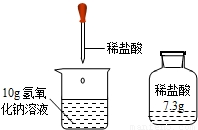
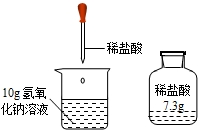
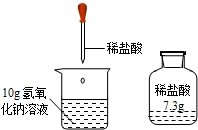 实验室有一瓶稀盐酸,如图所示,此盐酸溶液50g含溶质的质量______g.将此稀盐酸滴入盛有10g氢氧化钠溶液(滴有1--2滴酚酞试液)的烧杯中
实验室有一瓶稀盐酸,如图所示,此盐酸溶液50g含溶质的质量______g.将此稀盐酸滴入盛有10g氢氧化钠溶液(滴有1--2滴酚酞试液)的烧杯中
(1)若恰好完全反应现象为______.
(2)发生反应的化学方程式为______.
(3)恰好反应时消耗稀盐酸的质量为5g,则此NaOH溶液中溶质质量X的比例式为______.
(4)NaOH溶液中溶质的质量分数______.
(5)所得溶液中溶质的质量分数(酚酞试夜的质量不计)为______.
解:此溶液溶质质量分数是7.3%,则溶质质量是:50g×7.3%=3.65g,故答案为:3.65g
(1)酚酞变红是应为有氢氧化钠存在,恰好反应则是碱完全消耗,红色刚好褪去,故答案为:溶液由红色变为无色.
(2)此是酸碱发生的中和反应,答案为:NaOH+HCl=NaCl+H2O
(3)利用化学方程式计算解决.
设则此NaOH溶液中溶质质量X
NaOH+HCl=NaCl+H2O
40 36.5
x 5g×7.3%
则有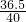 =
=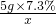 ,故答案为:
,故答案为: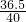 =
=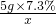
(4)由(3)中关于x的比例式知道,x=0.4g 则氢氧化钠的溶解度是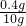 ×100%=4%
×100%=4%
(5)利用化学方程式结合溶质质量分数的求法解决.生成氯化钠质量是y
NaOH+HCl=NaCl+H2O
36.5 58.5
5g×7.3% y
 =
=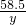
解得y=0.585g
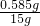 ×100%=3.9%
×100%=3.9%
故答案为:3.9%
分析:由标签可知:此溶液溶质质量分数是7.3%,利用溶质质量的求法解决.
(1)酚酞变红是应为有氢氧化钠存在,恰好反应则是碱完全消耗,红色褪去.
(2)结合实际书写此中和反应,产物是氯化钠与水.
(3)利用化学方程式计算解决.已知其中一种反应物求另一种反应物.
(4)利用(3)中的比例式求出x的数值,再利用溶质比溶液进行求解即可
(5)利用化学方程式求出溶质的质量,再结合溶质质量分数的求法解决.
点评:此题是对中和反应中各种关系的考查,分清题意结合实际要求的量,对条件进行透彻的分析是解题的关键,属于基础知识练习考查题.
(1)酚酞变红是应为有氢氧化钠存在,恰好反应则是碱完全消耗,红色刚好褪去,故答案为:溶液由红色变为无色.
(2)此是酸碱发生的中和反应,答案为:NaOH+HCl=NaCl+H2O
(3)利用化学方程式计算解决.
设则此NaOH溶液中溶质质量X
NaOH+HCl=NaCl+H2O
40 36.5
x 5g×7.3%
则有
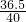 =
=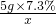 ,故答案为:
,故答案为: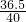 =
=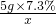
(4)由(3)中关于x的比例式知道,x=0.4g 则氢氧化钠的溶解度是
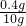 ×100%=4%
×100%=4%(5)利用化学方程式结合溶质质量分数的求法解决.生成氯化钠质量是y
NaOH+HCl=NaCl+H2O
36.5 58.5
5g×7.3% y
 =
=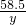
解得y=0.585g
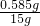 ×100%=3.9%
×100%=3.9%故答案为:3.9%
分析:由标签可知:此溶液溶质质量分数是7.3%,利用溶质质量的求法解决.
(1)酚酞变红是应为有氢氧化钠存在,恰好反应则是碱完全消耗,红色褪去.
(2)结合实际书写此中和反应,产物是氯化钠与水.
(3)利用化学方程式计算解决.已知其中一种反应物求另一种反应物.
(4)利用(3)中的比例式求出x的数值,再利用溶质比溶液进行求解即可
(5)利用化学方程式求出溶质的质量,再结合溶质质量分数的求法解决.
点评:此题是对中和反应中各种关系的考查,分清题意结合实际要求的量,对条件进行透彻的分析是解题的关键,属于基础知识练习考查题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 实验室有一瓶稀盐酸,如图所示,此盐酸溶液50g含溶质的质量
实验室有一瓶稀盐酸,如图所示,此盐酸溶液50g含溶质的质量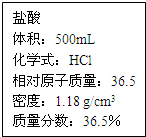 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.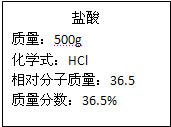 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题: