题目内容
【题目】某同学为了探究木炭和氧化铜在高温条件下生成的气体产物的成分,提出了如下猜想:
a.可能是二氧化碳; b.可能是一氧化碳。
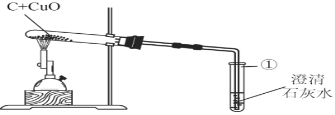
并设计如图所示装置进行实验,预期的实验现象及结论如下:
Ⅰ.若澄清的石灰水变浑浊,则气体为二氧化碳;
Ⅱ.若澄清的石灰水不变浑浊,则气体为一氧化碳.
请你分析并回答:
(1)该同学的猜想是否严谨?请你说明理由:_________;___________ ;
(2)设计一个实验,验证⑴中你的理由。请简述你的实验方案____________________________;
(3)该实验装置存在的缺陷是________________________;
(4)反应结束时,停止实验的操作步骤是________________________;
(5)实验后发现试管①内壁上附着不易用试管刷洗净的固体生成物,清洗试管①的方法是_______________________。
【答案】⑴不严谨;气体产物可能是 CO和 CO2的混合物;
⑵先将混合气体通入澄清石灰水,再通入足量 NaOH溶液,再通过盛装 CuO的硬质玻璃管加热, 观察现象,若 CuO变红则猜想正确;⑶没有尾气处理装置;
⑷先将导管移出水面,再熄灭酒精灯;
⑸在试管①中用足量稀盐酸清洗。
【解析】⑴据质量守恒定律,反应前后元素的种类不变,所以碳和氧化铜反应后的气体产物还可能是 CO和 CO2的混合物;⑵先将混合气体通入澄清石灰水,观察石灰水是否变浑浊验证二氧化碳,,再通入足量 NaOH溶液将二氧化碳吸收,再通过盛装 CuO的硬质玻璃管加热, 观察现象,若 CuO变红则猜想证明有一氧化碳;⑶一氧化碳是空气污染物,应添加尾气处理装置;⑷先将导管移出水面,再熄灭酒精灯,否则易导致水倒流使试管炸裂;⑸试管①内壁上附着不易用试管刷洗净的固体生成物,是二氧化碳和氢氧化钙反应生成的碳酸钙沉淀,碳酸钙和盐酸反应生成易溶于水的的氯化钙,所以在试管①中用足量稀盐酸清洗。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案