题目内容
【题目】化学是以实验为基础的科学,实验是科学探究的重要手段.某化学兴趣小组的同学利用下图微型实验装置进行探究实验。
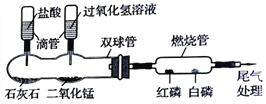
(1)写出一个双球管中可能反应的化学方程式。___________________________;
(2)挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件?_________________________________________。
(3)相同质量的磷、铁、镁分别在氧气中完全燃烧,消耗氧气最多的是_________。
【答案】 CaCO3+ 2HCl == CaCl2+ H2O + CO2↑或2H2O2MnO22H2O+O2↑ 温度达到可燃物着火点,可燃物与氧气接触 磷
【解析】(1)石灰石主要成分是碳酸钙,能与稀盐酸反应。过氧化氢溶液在二氧化锰作催化剂的条件下能迅速发生分解反应。CaCO3 + 2HCl== CaCl2 + H2O + CO2↑或2H2O2 MnO2 2H2O+O2↑(2)挤压右滴管并微热燃烧管,双球管内迅速发生反应生成氧气,氧气进入燃烧管,与氧气接触的白磷燃烧而红磷不燃烧,说明温度达到着火点才可以燃烧。
(3) 设磷、铁、镁的质量都是m,磷消耗氧气的质量是x,铁消耗氧气的质量是y,镁消耗氧气的质量是z。
4P + 5O2点燃2P2O5 3Fe + 2O2点燃Fe3O4 2Mg + O2点燃2MgO
124 160 168 64 48 32
m x m y m z
![]() =
=![]() 解得x=
解得x=![]() ,
, ![]() =
=![]() 解得y=
解得y=![]() ,
, ![]() =
=![]() 解得z=
解得z=![]()
所以消耗氧气最多的是磷。

【题目】利用石灰石煅烧来制备生石灰,要达到相当的纯度才可用,化验小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来一些矿石样品,并取稀盐酸200 g,平均分成四份进行实验,结果如表所示.
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)哪几次反应中矿石有剩余?________________ .
(2)上表中m的值是______________.
(3)试计算这种矿石中碳酸钙的质量分数为_____________.