题目内容
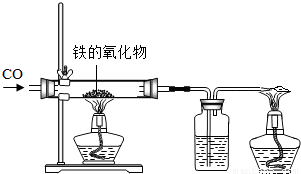
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为 _________ ;实验完毕称得洗气瓶的质量增加了 _________ g.
(2)某实验研究小组将6.5g由H2、O2、CO组成的混合气体置于密闭容器中点火爆炸.冷却至室温,干燥后测得气体质量为4.7g;再通入足量的苛性钠溶液,干燥后测得剩余气体质量为0.3g,经检验,这0.3g气体是氧气.求原混和气体中H2、O2、CO的质量各是多少?
(1)Fe3O4;11
(2)解:反应生成的CO2质量为:4.7g﹣0.3g=4.4g,生成H2O的质量为:6.5g﹣4.7g=1.8g,
设:原混合气体中含CO的质量为X,含H2的质量为Y,分别与质量为m、n的O2反应
2CO+O2 2CO2
2CO2
56 32 88
X m 4.4g

m=1.6g
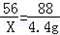
X=2.8g
2H2+O2 2H2O
2H2O
4 32 36
Y n 1.8g
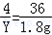
Y=0.2g
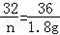
n=1.6g
则原混合气体中含O2的质量为:0.3g+1.6g+1.6g=3.5g (或:6.5g﹣2.8g﹣0.2g=3.5g).
答:原混和气体中H2、O2、CO的质量各是0.2g、3.5g、2.8g.
(2)解:反应生成的CO2质量为:4.7g﹣0.3g=4.4g,生成H2O的质量为:6.5g﹣4.7g=1.8g,
设:原混合气体中含CO的质量为X,含H2的质量为Y,分别与质量为m、n的O2反应
2CO+O2
 2CO2
2CO256 32 88
X m 4.4g

m=1.6g
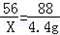
X=2.8g
2H2+O2
 2H2O
2H2O4 32 36
Y n 1.8g
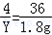
Y=0.2g
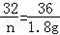
n=1.6g
则原混合气体中含O2的质量为:0.3g+1.6g+1.6g=3.5g (或:6.5g﹣2.8g﹣0.2g=3.5g).
答:原混和气体中H2、O2、CO的质量各是0.2g、3.5g、2.8g.

练习册系列答案
相关题目
 24、小红用下图装置制取二氧化碳,请完成下列问题:
24、小红用下图装置制取二氧化碳,请完成下列问题: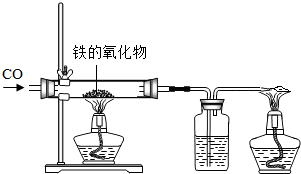 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为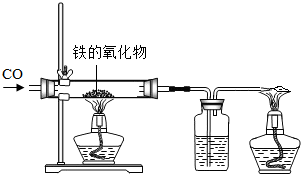 (1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g.
(1)小红用下图装置进行CO还原铁的某种氧化物实验,她先称量硬质玻璃管的质量为66.7g,往硬质玻璃管内放入该铁的氧化物后,称得铁的氧化物和硬质玻璃管的总质量是81.2g.然后通入CO并加热,使铁的氧化物与足量的CO充分反应,冷却后称得硬质玻璃管和管内残留固体的总质量是77.2g.由此推断,该氧化物的化学式为______;实验完毕称得洗气瓶的质量增加了______g.