题目内容
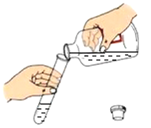
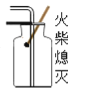
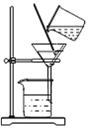
【题目】某课外研究小组通过下图所示两种不同的途径制取胆矾晶体。
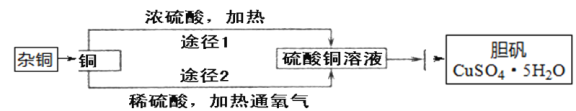
请回答下列问题:
(1)杂质铜中有含有少量的锌,可用_____浸泡几分钟的方法除去。
(2)通过途径2制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、________(填操作名称)、冷却结晶。请写出铜发生反应的化学方程式:_________。
(3)通过途径1制取胆矾的反应方程式为:Cu+2H2SO4(浓) ![]() CuSO4+2X+SO2↑,X的化学式为_______。与途径Ⅰ相比,途径Ⅱ的优点是__________(答出一点即可)。
CuSO4+2X+SO2↑,X的化学式为_______。与途径Ⅰ相比,途径Ⅱ的优点是__________(答出一点即可)。
【答案】稀硫酸 蒸发 2Cu+2H2SO4+O2![]() 2CuSO4+2H2O H2O 不会产生污染性气体二氧化硫
2CuSO4+2H2O H2O 不会产生污染性气体二氧化硫
【解析】
(1)锌和稀硫酸反应生成硫酸锌和氢气,铜不会与稀硫酸反应,所以杂质铜中有含有少量的锌,可用稀硫酸浸泡几分钟的方法除去;
(2)从溶液中得到晶体可以采用蒸发的方法,所以必须进行的实验操作步骤:酸溶、加热通氧气、蒸发、冷却结晶铜、氧气、稀硫酸在加热的条件下生成硫酸铜和水,化学方程式为:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
(3)化学反应前后,元素种类不变,原子个数不变,反应物中有1个铜原子,4个氢原子,8个氧原子,2个硫原子,生成物中有1个铜原子,2个硫原子,4个氧原子,所以X是H2O,浓硫酸和铜反应会生成二氧化硫,二氧化硫有毒,所以与途径Ⅰ相比,途径Ⅱ的优点是:不会产生污染性气体二氧化硫。
故答案为:(1)稀硫酸;
(2)蒸发,2Cu+2H2SO4+O2![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
(3)H2O,不会产生污染性气体二氧化硫。

练习册系列答案
相关题目