题目内容
【题目】空气中氧气含量测定的再认识
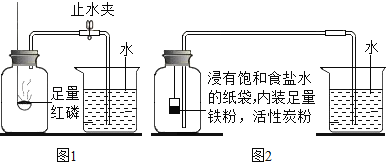
(实验问题)如图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
(1)写出红磷燃烧的化学方程式_____.
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内_____减小,烧杯中水倒吸到集气瓶,若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量.
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大.
(实验改进)
Ⅰ.铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_____.根据铁在空气中生锈的原理设计如图2实验装置,再次测定空气中氧气含量.(说明:装置中饱和食盐水、活性炭起加速铁生锈的作用).
Ⅱ.测得实验数据如下表:
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)根据上表计算,改进实验后测得的空气中氧气的体积分数是_____(计算结果精确到0.1%).
(2)从实验原理角度分析,改进后的实验结果比前者准确更高的原因是:①_____;②_____.
【答案】4P+5O2![]() 2P2O5 气压 2Fe+2H2O+O2═2Fe(OH)2 20.2% 铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确 测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确
2P2O5 气压 2Fe+2H2O+O2═2Fe(OH)2 20.2% 铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确 测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确
【解析】
(1)磷燃烧生成五氧化二磷,该反应的化学方程式为:4P+5O2![]() 2P2O5;
2P2O5;
(2)红磷燃烧消耗氧气,使瓶内的气压变小,水倒吸;
实验改进:(1)铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],该反应的化学方程式为:2Fe+2H2O+O2═2Fe(OH)2;
(2)根据反应前后烧杯内水的体积变化可以看出,消耗的氧气的体积是:80﹣54.5=25.5mL,故氧气的体积分数为:25.5mL/126mL×100%=20.2%;
(3)使用铁的缓慢氧化消耗氧气,使氧气消耗的更为彻底,实验结果更准确,测量时考虑导管容积和扣除内容物后的集气瓶的体积,使实验结果更为准确;

 作业辅导系列答案
作业辅导系列答案【题目】李老师在实验室制取了两瓶无色气体,分别置于实验台,如下图,请回答下列问题:
(1)据你所学习的化学知识,结合两种气体的放置情况判断,B气体密度特点是____;A气体可能是_________.
(2)根据你对A气体的判断,完成下列对该气体化学性质探究的实验报告。
实验步骤 | _________ |
实验现象 | _________ |
实验结论 | 该气体是_______________。 |