题目内容
某工厂化验室用15%的氢氧化钠溶液洗涤洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40克,洗涤后的溶液呈中性.(1)若配制所用氢氧化钠溶液480克,则需如图标签所示的氢氧化钠质量为g;
(2)发生反应的化学方程式;
(3)求这一定量石油产品中残余硫酸质量(X)的比例式为;
(4)若改用同样溶质质量分数的氢氧化钾溶液去恰好中和该一定量石油产品中的残余硫酸,需消耗氢氧化钾溶液质量为g;
(5)中和同样质量的硫酸,需氢氧化钠、氢氧化钾的质量比为.

【答案】分析:(1)利用溶质质量=溶液质量×溶液中溶质质量分数计算配制所用15%氢氧化钠溶液480克需要氢氧化钠的质量,再由标签中纯度,计算需如图标签所示的氢氧化钠质量;
(2)根据氢氧化钠与硫酸能发生中和反应,写出反应的化学方程式;
(3)根据反应的化学方程式,由反应中硫酸与氢氧化钠的质量关系,列出计算这一定量石油产品中残余硫酸质量(X)的比例式;
(4)根据氢氧化钾与硫酸反应的化学方程式,由恰好中和该一定量石油产品中的残余硫酸,计算需消耗氢氧化钾溶液质量;
(5)根据以上计算所需氢氧化钠、氢氧化钾质量,求出中和同样质量的硫酸,需氢氧化钠、氢氧化钾的质量比.
解答:解:(1)所用15%氢氧化钠溶液480g溶液需要含氢氧化钠96%的氢氧化钠的质量=480g×15%÷96%=75g;
(2)氢氧化钠与硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(3)根据反应的化学方程式,一定量石油产品中残余硫酸质量(X)与所用氢氧化钠的关系为
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
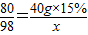
x=7.35g
(4)设需消耗氢氧化钾溶液质量为y
H2SO4+2KOH=K2SO4+2H2O
98 112
7.35g y×15%
 =
=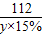
y=56g
(5)中和同样质量的硫酸,需氢氧化钠、氢氧化钾的质量比=(40g×15%):(56g×15%)=5:7
故答案为:
(1)75;
(2)H2SO4+2NaOH=Na2SO4+2H2O;
(3)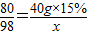 ;
;
(4)56;
(5)5:7.
点评:虽然氢氧化钠、氢氧化钾都可以中和硫酸,但由于两物质相对质量的差异,在中和同样质量的硫酸时,所消耗氢氧化钾的质量要大于氢氧化钠的质量很多.
(2)根据氢氧化钠与硫酸能发生中和反应,写出反应的化学方程式;
(3)根据反应的化学方程式,由反应中硫酸与氢氧化钠的质量关系,列出计算这一定量石油产品中残余硫酸质量(X)的比例式;
(4)根据氢氧化钾与硫酸反应的化学方程式,由恰好中和该一定量石油产品中的残余硫酸,计算需消耗氢氧化钾溶液质量;
(5)根据以上计算所需氢氧化钠、氢氧化钾质量,求出中和同样质量的硫酸,需氢氧化钠、氢氧化钾的质量比.
解答:解:(1)所用15%氢氧化钠溶液480g溶液需要含氢氧化钠96%的氢氧化钠的质量=480g×15%÷96%=75g;
(2)氢氧化钠与硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(3)根据反应的化学方程式,一定量石油产品中残余硫酸质量(X)与所用氢氧化钠的关系为
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
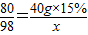
x=7.35g
(4)设需消耗氢氧化钾溶液质量为y
H2SO4+2KOH=K2SO4+2H2O
98 112
7.35g y×15%
 =
=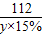
y=56g
(5)中和同样质量的硫酸,需氢氧化钠、氢氧化钾的质量比=(40g×15%):(56g×15%)=5:7
故答案为:
(1)75;
(2)H2SO4+2NaOH=Na2SO4+2H2O;
(3)
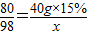 ;
;(4)56;
(5)5:7.
点评:虽然氢氧化钠、氢氧化钾都可以中和硫酸,但由于两物质相对质量的差异,在中和同样质量的硫酸时,所消耗氢氧化钾的质量要大于氢氧化钠的质量很多.

练习册系列答案
相关题目
 某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40克,洗涤后的溶液呈中性.
某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40克,洗涤后的溶液呈中性.