题目内容
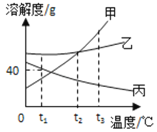
【题目】甲、乙、丙三种物质的溶解度曲线如图所示(不含结晶水),请回答:
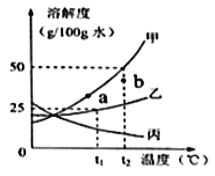
(1)t2℃时,将30g甲固体加入到50g水中,充分搅拌后的所得溶液是_____(填“饱和”“不饱和”)。
(2)若甲中含有少量乙,应用________法提纯甲。
(3)等质量的甲、乙、丙三种饱和溶液从t2℃降温至0℃后,溶液的质量分数由大到小的顺序是 _________。
(4)若使甲溶液的状态从a点转化为b点,可采取的措施是 ______________。
【答案】饱和 降温结晶 乙>甲>丙 升温
【解析】
(1)由图可知,t2℃时,甲固体的溶解度为50g,则t2℃时,将30g甲固体加入到50g水中只能溶解25g,形成的溶液为饱和溶液,故填饱和。
(2)由图可知,甲固体的溶解度受温度影响比乙固体大,所以甲中含有少量乙,应用降温结晶的方法提纯甲,故填降温结晶。
(3)等质量的甲、乙、丙三种饱和溶液从t2℃降温至0℃后,甲、乙溶液均为饱和溶液,且乙固体的溶解度大于甲固体的溶解度,所以乙溶液的溶质质量分数>甲溶液的溶质质量分数,由图可知,丙固体的溶解度随温度降低反而增大,溶液变为不饱和溶液溶质质量分数不变,仍最小,所以0℃时三种溶液的溶质质量分数由大到小的顺序是乙>甲>丙,故填乙>甲>丙。
(3)由图可知,b点时的温度高于a点,故填升温。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
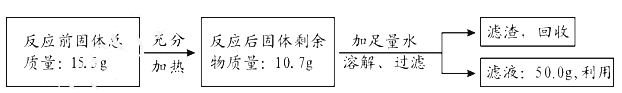
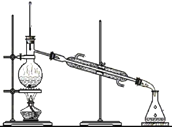
鹰派教辅衔接教材河北教育出版社系列答案【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
I、吕布兰法
1789年,法国医生吕布兰 (N.Leblanc,1742﹣1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
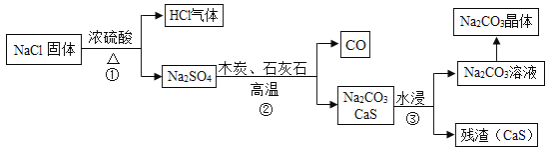
(1)碳酸钠俗称_____。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为 ___________。
(3)③中“水浸”时通常需要搅拌,其目的是________。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
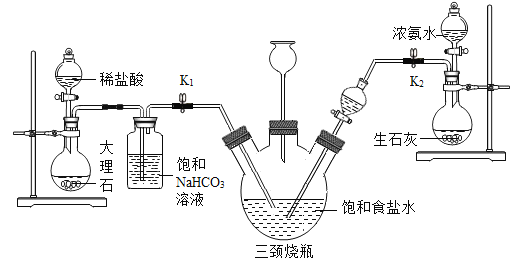
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____;
(6)三颈烧瓶上连接的长颈漏斗的主要作用是_____
(7)①根据实验记录,计算t2时 NaHCO3固体的分解率 (已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_________。
②若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____ (填“偏大”、“偏小或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。下列认识或理解正确的是_____
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的利用率,它符合当今“绿色化学”的理念。
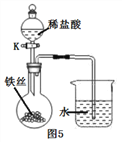
【题目】水是一种重要的物质,在日常生活和和生产实践中有着不可替代的作用。
|
|
|
|
图1 | 图2 | 图3 | 图4 |
(1)水的净化
①图1所示净水器可除去水中的色素和异味,是因为其中的活性炭具有_____________性。
②在图1和图2示意的净水原理中,能降低水硬度的净水方法是图______(填“1”或2)。
(2)水的组成。
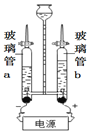
①图3是水的电解装置,接通直流电源一段时间后,玻璃管b内产生的气体是__________________,该反应的化学方程式为_____________________________。
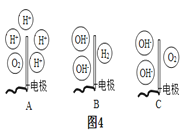
②电解水的实验中,在玻璃璃管里加含有酚酞的硫酸钠溶液,可以增强导电性。在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈_______(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,则图4中能表示电解时管b中水在电极端所发生变化得到的粒子是_____(填对应选项的字母)。
(3)水在化学实验中具有重要作用。
将铁丝放在潮湿的空气中(如图5所示),关闭K,一段时间后,观察到导管内液面上升;打开K,观察到导管内液面下降,导管口有气泡出。请解释导管内液面上升和下降的原因:_________________________。