题目内容
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性。他们经过思考设计并进行了以下实验
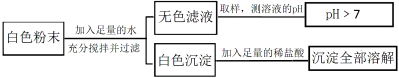
请分析实验过程,回答下列问题:
(1)白色粉末中一定不含 ,可能含有 。
(2)生成白色沉淀的化学方程式为 。
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
[提出问题]无色滤液中呈碱性的物质是什么?
[做出猜想]猜想Ⅰ:Na2CO3。 猜想Ⅱ:NaOH。 猜想Ⅲ: 。
[进行实验]
实验步骤 | 实验现象 | 实验结论 |
①取无色滤液少许于试管中,滴加过量的BaCl2溶液。 | 产生白色沉淀。 | 猜想Ⅱ不成立。 |
②在①反应后的试管中滴加 。 | 溶液变为红色。 | 猜想Ⅲ成立。 |
[得出结论]白色粉末的成分是 。
【答案】(1) CuSO4、Na2SO4 NaOH(2) BaCl2+Na2CO3==BaCO3↓+2NaCl
(3) Na2CO3和NaOH 无色酚酞溶液 Na2CO3、BaCl2和NaOH
【解析】
试题分析:加入水后没有颜色,说明其中一定不含有硫酸铜,沉淀加入盐酸后沉淀完全消失,一定含有碳酸钠和氯化钡,一定不含有硫酸钡,可能含有氢氧化钠,生成白色沉淀的化学方程式为BaCl2+Na2CO3==BaCO3↓+2NaCl,最后得到的滤液可能是:碳酸钠或者氢氧化钠或者二者的混合物,取无色滤液少许于试管中,滴加过量的BaCl2溶液。产生白色沉淀,将碳酸钠除掉,在滴入酚酞后变为红色,说明含有氢氧化钠。

【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。
【题目】化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)

(1)实验记录
序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡E中出现浑浊 | E中反应的化学方程式为_________ |
② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体G中产生黑色沉淀 | 反应产物一定有____和______ |
③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有___ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的_____________。
②装置B中发生的反应的化学方程式是__________________,若无装置C,对实验有影响的物质是_________。
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,________________________。
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)____________

