题目内容
20.在CO和CO2的混合气体中,氧元素的质量分数为64%,将混合气体10g先通入足量灼热氧化铜中,再通入足量的石灰水中,得到白色沉淀物( )| A. | 15g | B. | 10g | C. | 5g | D. | 30g |
分析 根据混合气体的质量与氧元素的质量分数可计算碳元素的质量分数、碳元素的质量,然后利用反应前后碳元素质量守恒来计算生成碳酸钙的质量.
解答 解:在CO和CO2的混合气体中,氧元素的质量分数为64%,此混合气体10g中含碳元素的质量为10g×(1-64%)=3.6g,
该混合气体通过灼热氧化铜后,全部转化为二氧化碳,二氧化碳与石灰水反应形成碳酸钙沉淀,根据化学变化前后碳元素质量不变,
则最多可得到白色沉淀为:3.6g÷$\frac{12}{40+12+16×3}$×100%=30g.
故选:D.
点评 本题有一定难度,巧妙利用元素守恒的方法,判断出所生成沉淀中所含碳元素质量即原混合气体中碳元素质量是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列物质的使用,不利于人体健康的是( )
| A. | 用食醋作调味剂 | B. | 将“塑化剂”添加到饮料中 | ||
| C. | 用碳酸钙作补钙剂 | D. | 食品包装袋内充氮气防腐 |
12.小强用托盘天平称量5.1g食盐时,1g以下用游码,称后发现砝码放在了左盘食盐放在了右盘.所称食盐的实际质量为( )????
| A. | 5.3g | B. | ?5.1g | C. | 5.0g | D. | ?4.9g |
9.下列物质的鉴别方法不正确的是( )
| A. | 用观察法区别铁丝与铜丝 | B. | 用闻气味的方法鉴别水和酒精 | ||
| C. | 用肥皂水鉴别硬水和软水 | D. | 用燃烧的木条鉴别二氧化碳和氮气 |
10.下列有关空气的说法不正确的是( )
| A. | 水生生物在水中生存需要消耗氧气,因为氧气极易溶于水 | |
| B. | 城市美丽的霓虹,因为稀有气体在通电时发出不同颜色的光 | |
| C. | 氮气常用作保护气,因为其化学性质不活泼 | |
| D. | 酉阳的空气中氧气含量与西藏一样,因为西藏的空气比酉阳稀薄 |
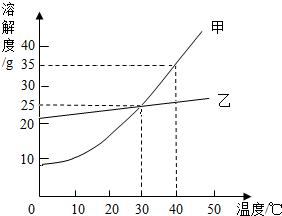 如图是甲、乙两固体物质的溶解度随温度变化的曲线图,据此我能回答下列问题:
如图是甲、乙两固体物质的溶解度随温度变化的曲线图,据此我能回答下列问题: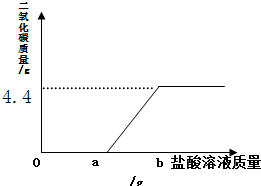 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3
一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3