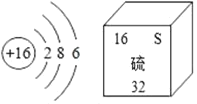
题目内容
现有一包由5.6g铁、7.2g镁、1.4g碳混合而成的粉末,把它加入一定量的Cu(NO3)2溶液中。实验结束后,测得剩余固体中含有三种物质。则剩余固体的质量可能会( )
A. 25.8g B. 26.8g C. 27.8g D. 28.8g
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案某废液 M 可能含有 NaCl、NaOH、Na2CO3、Na2SO4 中的一种或几种,为确定其成分进行实验探究。
(资料信息)
物质 | NaCl | NaOH | Na2CO3 | Na2SO4 |
常温下溶液的 pH | 7 | 13 | 11 | 7 |
(探究过程)
实验步骤 | 实验现象 | 实验结论 |
步骤一:取适量废液 M 于试管 中,滴加无色酚酞试液。 | 无色酚酞变红色 | 有同学认为废液 M 中一定含有 NaOH。 请你对该结论作出判断并说明理由_____。 |
步骤二:重新取适量废液 M 于 试管中,滴加足量的稀盐酸。 | 有气泡产生,产生的气体 能使澄清石灰水变浑浊 | 废液 M 中一定含有______。判断依据 是_____(用化学方程式表示) |
步骤三:再重新取适量废液 M 于试管中,先滴加过量的稀硝酸,再滴加过量的_____溶液,静置。 | 有白色沉淀 | 由步骤三、步骤四可知:废液 M 中一定有_____。 |
步骤四:取步骤三中的上层清 液,滴加过量的_____溶液。 | 有白色沉淀 |
(实验反思)步骤三空中滴加的溶液一定要过量的原因是_____。
下列实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将带火星的木条伸入盛有某无色气体的集气瓶中 | 木条复燃 | 该无色气体为氧气 |
B | 向某溶液中加入稀盐酸,将产生的气体通入足量的澄清石灰水中 | 产生气泡,澄清石灰水变浑浊 | 该溶液中一定含有CO32﹣ |
C | 向某溶液中滴入2~3滴酚酞溶液 | 溶液由无色变红色 | 溶液一定是碱的溶液 |
D | 点燃某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有水珠 | 该气体一定为氢气 |
A. A B. B C. C D. D


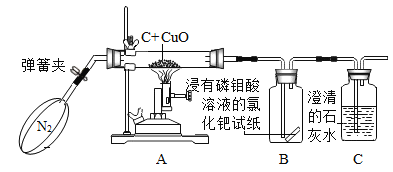

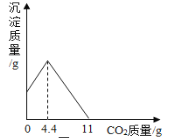
 加热液体 B.
加热液体 B.  蒸发食盐水
蒸发食盐水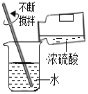 稀释浓硫酸 D.
稀释浓硫酸 D.  二氧化碳验满
二氧化碳验满