题目内容
【题目】氯化钠是日常生活的必需品,也是重要的化工原料,海水“晒盐”得到的是粗盐。粗盐除含NaCl 外,还含有少量 MgCl2、CaCl2、Na2SO4以及泥沙等杂质
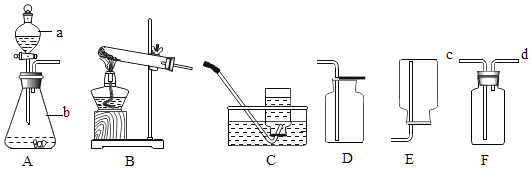
(1)有关粗盐提纯的实验操作合理的是___(填序号)。
A 溶解前用玻璃棒研磨大颗粒粗盐
B 过滤时液体的液面要低于滤纸边缘
C 蒸发时要不断搅拌直至水分全部蒸干
D 实验结束用玻璃棒把固体转移到纸上,称量后,回收到指定容器中
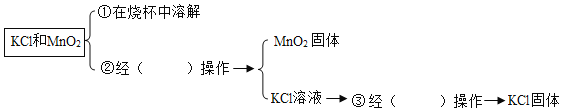
(2)粗盐进行精制,流程如图。

温合液Ⅲ经过“过滤”操作,得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、___(填化学式)
(3)加入过量的NaOH溶液的目的为___(用化学方程式表示)。
(4)实验所得精盐的质量大于粗盐中NaCl的质量,原因是___。
【答案】BD CaCO3和BaCO3 MgCl2+2 NaOH=2NaCl+ Mg(OH)2↓ 除杂质过程中新生成了氯化钠
【解析】
(1)
A、研磨大颗粒粗盐应该用研钵和杵,选项操作不合理;
B、过滤时要使液体的液面低于滤纸边缘,选项操作合理;
C、蒸发时要用玻璃棒不断搅拌,防止局部温度过高,造成液滴飞溅,加热到出现较多量固体时停止加热,利用蒸发皿的余热蒸干滤液,不能加热直至水分全部蒸干,选项操作不合理;
D、实验结束用玻璃棒把固体转移到纸上,称量后,回收到指定容器中,选项操作合理,故符合题意的填BD;
(2)氯化钡和硫酸钠反应生成硫酸钡沉淀,氢氧化钠和氯化镁反应生成氢氧化镁沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,碳酸钠还和过量的氯化钡反应生成碳酸钡沉淀,所以混合液III经过“过滤”操作,得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3和BaCO3,故填CaCO3和BaCO3;
(3)加入过量的NaOH溶液的目的是除尽溶液中的镁离子,使氯化镁和氢氧化钠完全反应生成氢氧化镁沉淀和氯化钠,方程式故填MgCl2+2 NaOH=2NaCl+ Mg(OH)2↓;
(4)在除去MgCl2、CaCl2、Na2SO4杂质的过程中,以及最后酸化过程中都新生成了氯化钠,使得实验所得精盐的质量大于粗盐中NaCl的质量,故填除杂质过程中新生成了氯化钠。

【题目】下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 |
甲 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
乙 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
丙 | 0.182 | 0.165 | 0.160 | 0.141 | x | 0.121 |
① 10℃时,甲物质的溶解度是_______g/100g水;
② 三种物质中溶解度受温度影响较大的是______;
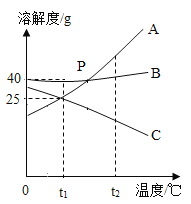
③ 物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_________;

④ 30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
⑤ 50℃时,三种物质的溶解度由大到小的顺序是_____;
⑥ 向不同温度的100 g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是______;
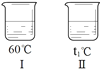

a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体全部溶解,溶质质量分数可能不变
【题目】现有A~F六种稀溶液,分别是碳酸钠溶液、氢氧化钠溶液、氢氧化钙溶液、稀盐酸、氯化钠溶液、酚酞溶液中的一种,把他们两两混合,其部分现象如下表所示。
B | C | D | E | |
A | 无明显变化 | 白色沉淀 | 无明显变化 | 液体变红色 |
B | 气体逸出 | 无明显变化 | 无明显变化 |
(1)①B、E中的溶液分别是______、______。
②A与C中发生反应的化学方程式为______。
(2)对还没有确定的稀溶液,下列鉴别方法中错误的是______(填序号)。
①分别蒸发溶剂 ②分别滴加适量水 ③分别滴加FeCl3溶液 ④分别测定pH ⑤分别通入CO2后,再滴加稀盐酸
(3)相同质量、相同溶质质量分数的氢氧化钾溶液与盐酸相混合后,滴加紫色石蕊溶液,溶液呈______色。